|
La fisiología del equilibrio ácido base (AB) puede ser
interpretada a través de un análisis físico químico,
como lo describió Peter Stewart hace aproximadamente 20
años. Este “nuevo” enfoque fue ignorado hasta no hace
mucho tiempo, seguramente por considerarse un tanto
complicado en lo que respecta a la operatividad del
mismo. Tal vez, los enfoques tradicionales, son
insuficientes para explicar los trastornos que ocurren
en determinadas situaciones.
La diferencia más importante del enfoque de Stewart con
respecto al tradicional es que los iones H+ y CO3H- no
son variables independientes, sino que en realidad, la
concentración de los mismos es determinada por otros
factores.
Por lo tanto un cambio en el pH no resulta de la
remoción ó generación de dichos iones, lo hace a
consecuencia de modificación en otras variables.
Es la tierra quien gira alrededor del sol y no la
inversa, tal como lo estableció Copérnico hace algunos
siglos. Por lo tanto, como dice John Kellum y haciendo
un parangón entre lo astrónómico y lo fisiológico,
parecería que el universo AB, no gira alrededor de los
iones H+ y CO3H-.
Ambos enfoques son perfectamente compatibles, y su
diferencia se basa en los mecanismos que explican su
comportamiento. La observación de que la acidosis
metabólica se asocia a disminución del CO3H- y del EB es
valida. Sin embargo, suponer que estos cambios son los
causantes de la acidosis no parece ser correcto.
El enfoque de Stewart, nos propone comprender la
fisiología AB a través de principios fisicoquímicos:
electroneutralidad, conservación de masas y disociación
de electrolitos. La cuestión básica en este enfoque es
la presencia de tres factores independientes que
controlan los cambios en el AB. A saber: presión de
dioxido de carbono (PCO2), diferencia de iones fuertes
(SID, del ingles: strong ion diference) y la
concentración total de ácidos débiles (ATOT).
El rol de la PCO2 en un sistema abierto como se entiende
que ocurre con el control del sistema respiratorio, es
similar al del enfoque tradicional, con la ecuación de
Henderson-Hasselbach (HH), ó sea:
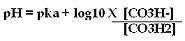
Los iones fuertes son aquellos que se disocian completa
ó casi completamente en una solución. Los más
importantes son el Na+, K+ y Cl- . Es la diferencia
existente entre los mismos y no los valores absolutos,
los determinantes de los fenómenos que pueden modificar
el comportamiento AB. A medida que disminuye la
diferencia entre estos iones fuertes (SID), la [H+]
aumenta y por lo tanto disminuye el pH.
En cuanto a los ATOT , el más importante es la albúmina
y en menor grado el fosfato.
Entonces estos tres factores independientes, controlaran
otros factores dependientes: H+ , OH- y CO3H-
Ahora bien: ¿Cuál es el origen de los iones H+ en el
enfoque de Stewart?. En base a lo que observamos en el
apartado anterior, es la disociación de las moléculas de
H2O.
Virtualmente todas las soluciones biológicas contienen
H2O, lo que constituye una fuente inagotable de H+.
Entonces, la [H+] en dicha solución, estará determinada
por la disociación del H2O, en H+ y OH-. Dicho esto de
otro modo, la [H+] estará dada, no como resultado de
cuantos protones sean adicionados o removidos de la
solución en cuestión, sino como consecuencia de la
disociación del H2O.
Obviamente, los factores que determinan la disociación
del H2O, son las leyes de la física y la química:
• Electroneutralidad: en una solución acuosa, la suma de
todos los iones de carga positiva (cationes) debería ser
igual a la suma de todos los iones de carga negativa
(aniones).
• Ley de conservación de masas: en toda reacción
química, la masa se conserva; esto es, la masa total de
los reactivos, es la masa total de los productos. O sea
que la masa no se crea ni se destruye, se transforma.
La teoría atómica ha permitido interpretar en forma más
sencilla esta ley del siguiente modo:
Si en una reacción química, no son los átomos los que se
alteran, sino que son únicamente las moléculas, el
número de átomos de los reactivos, coincidirán con el
correspondiente de los productos.
Por lo tanto, en H2O pura, la cantidad de iones H+ y OH-
deberían se iguales.
Entonces hay tres determinantes que predicen, el
comportamiento de la [H+] en una solución aún tan
compleja como es el plasma:
1. SID: balance de la carga neta de los iones capaces de
disociarse completa ó casi completamente. A los fines
operativos se calcula de la siguiente forma: (Na+ + K+ +
Ca++ + Mg++) – (Cl- + Lactato-). Esto también se refiere
como SID aparente (SID ap) ya que hay algunos iones que
no son medidos.
2. PCO2: variable independiente, siempre y cuando se
asuma que el sistema es abierto, ó sea que la
ventilación este presente.
3. ATOT: es una variable independiente no determinada
por ninguna otra
Los iones fuertes, por el principio de conservación de
masas, no pueden ser creados ni destruidos y para
satisfacer las leyes de la electroneutralidad, los iones
H+ son generados ó consumidos por cambios en la
disociación del H2O.
Es necesario entender como se regulan estas tres
variables independientes.
El nuevo enfoque, no establece cambios en lo que
respecta a la medición de los trastornos AB. Simplemente
cambia la interpretación. La cuantificación de un
trastorno AB es complementario al análisis
fisicoquímico. Por ejemplo, el exceso de bases standard
(EBS) puede utilizarse para cuantificar cambios en el
SID. Se puede entender como el total de modificación del
SID que es requerido para restaurar el pH a 7,40 a una
PaCO2 de 40 mmHg. En el caso de un EBS negativo, el
valor de este, se refiere a la cantidad de SID que
debería incrementar. Esto se debe a que el SID es
esencialmente igual a la base buffer (BB) propuesta por
Singer y Hastings en el año 1948 y el EBS cuantifica el
cambio en la BB. Recordemos que la BB, es la suma del
CO3H- y de los buffers ácidos débiles no volátiles. Es
de destacar que el EBS es más útil que el exceso de
bases (EB), ya que el primero “se estandariza” para
tener en cuenta la diferencia entre el equilibrio de CO2
in vitro e in vivo. El EBS provee una estimación de la
cantidad de anión fuerte que necesita ser removidos ó
cationes fuertes que tienen que ser adicionados para
normalizar el pH. Por ejemplo, para que el EBS se
modifique de -20 a -10 con el agregado de CO3HNa, la [Na+]
sérico debería aumentar 10 mEq/litro.
|
|
|
|
|
|
|
|
|
|
|
Artículos
Especiales en
Clínica-UNR.org
de estos autores: |
|
|
|
|
|
|
|
|
|
|
|