|
Discusión del caso
clínico
Dr. Gastón Chiganer
·
Mujer de 48 años.
·
Motivo de consulta: Fiebre, vómito y
mialgias
·
Exámen físico: Ictericia (bilirrubinoestasis)
·
Laboratorio: Leucocitosis y
plaquetopenia
·
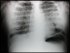
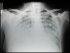
Radiología: Infiltrados pulmonares
bilaterales
·
Evolución: Hemorragia digestiva
·
Antecedente: Insuficiencia renal
crónica
ICTERICIA:
La ictericia se define como la
coloración amarillenta de piel y mucosas por aumento de la
bilirrubina. Clínicamente es detectable si supera los 2-3
mg/dl. Existen múltiples clasificaciones que engloban las
distintas etiologías, nosotros aquí nos permitiremos
subdividirlas en cuanto al tipo de bilirrubina que
prevalece. Las ictericias a predominio de bilirrubina
indirecta como las producidas por alteración en la
conjugación o eliminación, al igual que las ocasionadas
por hemólisis no las vamos a describir ya que la paciente
presentaba hiperbilirrubinemia conjugada. De estas podemos
descartar fácilmente las obstructivas, ya que a la
paciente se la realizaron dos ecografías que no mostraron
ni dilatación de la vía biliar ni litos y el laboratorio
no era de colestasis. Las de causa hepática cómo las
hepatitis alcohólicas cursan con aumento de las
transaminasas (ASAT sobre ALAT > a 2 y no mayor ambas a
400 mg/dl), la debidas a los virus hepatotrópos también
ocasionan hipertransaminasemia a predominio de ALAT sobre
ASAT y las por fármacos o tóxicos generalmente resuelven
luego de 48-72 hs. de retirado el agente lesivo y en la
paciente no sólo que no ocurrió esto sino que no contamos
con el antecedente de ingesta previa al comienzo del
cuadro de ningún medicamento ni de alcohol. Otras causas
probables son la ictericia por hígado de sepsis y la
necrosis hepatocelular por leptospirosis, que describiré
con detalle a continuación.
SEPSIS:
Actualmente se la considera como la
respuesta del organismo a la infección y se reconoce por
un conjunto de manifestaciones clínicas, hemodinámicas,
hematológicas, bioquímicas e inflamatorias que forman
parte de una respuesta global. Debe admitirse que la misma
no es un diagnóstico definido sino un conjunto de síntomas
y signos que pueden o no estar asociados a una evidencia
definitiva de infección.
La sepsis sistémica puede adquirirse
en la comunidad, generalmente a partir procesos
infecciosos genitourinarios (20-50%) o gastrointestinales.
Los nosocomiales, que comprenden el 75% de todos los
casos, se pueden originar en los aparatos urinario (20%),
intraabdominal (20-30%), accesos vasculares (16%) y
respiratorio. Habitualmente se asocian a una cirugía
previa o con el empleo de dispositivos invasivos, y son
causadas por gérmenes más resistentes a los antibióticos.
En un estudio francés, se halló una mayor proporción de
gérmenes Gram positivos que los Gram negativos (51% vs.
44%). Es posible demostrar que los episodios de
bacteriemia se deben en muchos casos a la flora del
huésped más que a la contaminación cruzada con las
bacterias del medio hospitalario. En este sentido, las
manipulaciones iatrogénicas que sufre el paciente
hospitalizado lesionan las defensas fisiológicas y
anatómicas, lo que permite el sobrecrecimiento de la flora
autóctona con la subsecuente traslocación bacteriana y la
eventual sepsis sistémica.
El diagnóstico precoz de sepsis en
los pacientes graves puede ser extremadamente dificultoso.
Si el paciente séptico no tiene neutropenia, más del 90%
de las veces presentará un foco evidente de infección.
Presumiblemente la mayoría de estos pacientes desarrollan
una bacteriemia a partir de los gérmenes de la piel o del
intestino, como consecuencia de pequeñas áreas de daño que
son de difícil diagnóstico clínico. La historia clínica
del paciente puede revelar situaciones o procedimientos
causales de sepsis. El dolor localizado puede ayudar a
indicar el sitio probable de infección. Las infecciones
intraabdominales deben ser sospechadas en cualquier
paciente que haya sido sometido a cirugía, traumatismo o
enfermedades que involucren el colon, intestino delgado o
tracto biliar.
Laboratorio: generalmente se
encuentra una cifra de glóbulos rojos próxima a lo normal,
la leucocitosis (entre 12000 a 30000 elementos/mm3) con
neto predominio de neutrófilos son característicos aunque
puede hallarse neutropenia. La cifra de plaquetas está
generalmente descendida, próxima a 100000/mm3, pero no
llega a los niveles que determinan diátesis hemorrágicas.
También se encuentra hiperglucemia, hiperazoemia,
hipocloremia, hiponatremia e hiperpotasemia. Puede
hallarse alteraciones en la coagulabilidad, con una
primera etapa de hipercoagulabilidad, seguida por el
consumo de los factores e hipocoagulabilidad. Las
investigaciones bacteriológicas son imprescindibles en la
evaluación de los pacientes sépticos, se debería tomar
muestras de sangre, orina y toda secreción dudosa antes
del inicio de los antibióticos.
Diagnóstico por imágenes: la
evaluación de los pacientes sépticos sin signos de
localización plantea un serio problema diagnóstico. En los
pacientes severamente enfermos con disfunción orgánica
múltiple o con alteración del estado de conciencia, puede
ser muy difícil el reconocimiento del lugar de origen de
la sepsis. La metodología recomendada consiste en evaluar
una serie de imágenes guiadas para evaluar los lugares más
comunes de infección. La secuencia, que no cuenta con un
consenso global, incluye radiografía y eventual tomografía
de senos paranasales, radiografía de tórax, ecografía o
preferentemente tomografía computada de abdomen, seguida
de la aspiración si se detecta un área sospechosa. Se
puede continuar con centellografía.
El
hígado en la sepsis
El
hígado es un órgano central en la homeostasis, con
importantes funciones metabólicas, inmunológicas, y
depurativas de sustancias tóxicas endógenas y exógenas.
Desde tiempos de Hipócrates se sabe que estas funciones
pueden alterarse precozmente por fenómenos asociados a la
sepsis, tales como hipermetabolismo, hipotensión e
isquemia tisular. Así, y de manera secundaria, el hígado
puede convertirse en un órgano causante y perpetuador de
fracaso multiorgánico.
Definición e incidencia:
La
disfunción hepática puede definirse de muchas maneras.
Quizá la más común sea la elevación de la bilirrubina por
encima de 2 mg/dl, de acuerdo a los criterios de la escala
SOFA de fracaso multiorgánico. A este criterio puede
asociarse elevación del RIN, e incremento del 100% de los
niveles de transaminasas. No obstante, y como veremos,
estos signos pueden ser inespecíficos y tardíos con
respecto al verdadero inicio de la afectación hepática.
La
disfunción hepática en la sepsis no es infrecuente,
estimándose su incidencia en un 62% de enfermos sépticos
ingresados en UCI y en un 0,15% del total de enfermos
críticos. Sin embargo, si se excluyen pacientes con
hepatopatía o neoplasia, otros autores hablan de un 6 %.
El origen principal de la sepsis es el foco abdominal, y
el agente más frecuente E. coli..
Patogenia:
El hígado
puede afectarse por la sepsis en dos momentos
cronológicos, generando un daño hepático primario y otro
secundario con consecuencias patológicas diferentes.
El daño
primario obedece a la disfunción orgánica vascular en el
inicio de la sepsis. La sepsis grave y el shock séptico
pueden provocar hepatitis isquémica por hipoperfusión. El
hígado es un órgano relativamente resistente a la
isquemia, puesto que se precisa un 70% de reducción del
flujo sanguíneo para comprometer su extracción de oxígeno.
Cuando esta reserva se agota, la isquemia hepática produce
depleción de ATP mitocondrial y necrosis celular
centrolobulillar. En función de la masa celular afectada
aparecen diferentes fenómenos analíticos y clínicos:
aumento de transaminasas de hasta 20 veces, hipoglucemia,
alteración de conciencia, acidosis láctica, coagulación
intravascular diseminada (CID) e insuficiencia renal.
Seeto y col. realizaron un estudio comparativo entre 31
enfermos que presentaron hipotensión mantenida (tensión
arterial media menor de 75 mmHg durante más de 15 minutos)
y signos de hepatitis isquémica, frente a pacientes
traumatizados con hipotensión pero sin hepatitis. Los
resultados mostraron que la hepatitis se relacionaba en un
97% de los casos con la presencia de fracaso cardiaco
derecho por lesión subyacente. Concluyen que el fenómeno
de la hepatitis isquémica pudiera estar relacionado con un
obstáculo al flujo a nivel portal, o por daño crónico de
los hepatocitos sometidos a disfunción cardiaca derecha.
Este hecho indica que el principal factor de la lesión
hepática isquémica puede no ser la hipoperfusión (shock,
trauma, etc.), necesitando de otros factores. De hecho,
sólo 2 pacientes de 31 presentaron signos de sepsis, con
lo que puede concluirse que la isquemia no es el mecanismo
predominante de daño hepático en la sepsis.
El daño
secundario viene producido por la acción de bacterias y
endotoxinas. Esta disfunción celular parece anterior e
independiente a los fenómenos hemodinámicos primarios de
la sepsis, como se ha demostrado en modelos animales: en
ratas, el flujo hepático aumentado no parece prevenir la
disfunción hepatocelular. La fisiopatología de esta lesión
se explica en el siguiente apartado.
Fisiopatología e histología:
La
endotoxina bacteriana se une al macrófago hepático, o
célula de Kupffer, promoviendo la liberación de citokinas
como el TNF-α y las interleuquinas IL-1 e IL-6. Son estas
moléculas quienes ejercen acciones a nivel bioquímico y
celular. A nivel bioquímico sobre la captación y
transporte de compuestos biliares, y a nivel celular
mediante la interacción de diversas células con daño final
a través de los neutrófilos.
Podemos
distinguir dos niveles de lesión: el bioquímico y el
celular.
3.1 A
nivel bioquímico
La formación de
bilis es un proceso osmótico que comprende secreción
activa de solutos orgánicos e inorgánicos, más un
transporte pasivo de agua. El paso limitante en la
formación de bilis es la captación de bilirrubina y ácidos
biliares a nivel de la porción sinusoidal (vascular) de
los hepatocitos. A nivel bioquímico la producción de
citokinas origina un transporte alterado de la bilirrubina
y ácidos biliares conjugados en las porciones basal y
apical de la membrana celular. La causa estriba en un
déficit de síntesis de un grupo de proteínas
transportadoras de sales biliares, y dependientes de los
canales del sodio, conocidas como NTCP. Por otro lado la
secreción canalicular tiene lugar principalmente por la
acción de la proteína BSEP (bomba secretora de sales
biliares) dependiente de ATP; otros sistemas ATP
independientes (MRP2, ABCC2, cMOAT) pueden transportar
múltiples aniones orgánicos y drogas.
La deficiencia
de síntesis de estas proteínas se origina por la acción de
la endotoxina y citokinas a través de receptores de
membrana (RAR), y nucleares como el NFκB y el sistema HNF.
La afectación de estos sistemas puede disminuir la
transcripción genética para la síntesis de mRNA
codificador de proteínas de transporte. Este efecto ha
sido estudiado en modelos animales, observándose una
inhibición del flujo y la secreción biliar al administrar
tanto endotoxina, como citokinas. Estos resultados indican
que la endotoxina, junto con la liberación de mediadores
ocasionada por ella, afecta gravemente el transporte de
todos los compuestos orgánicos biliares, mediante un
defecto de síntesis. La endotoxemia y las citokinas pro
inflamatorias también producen una inhibición de la
secreción de aniones inorgánicos como el bicarbonato.
3.2 A
nivel celular
La
endotoxemia y el aumento de citokinas originan una mayor
expresión de moléculas endoteliales de adhesión, como la
ICAM-1, e integrinas como la Mac-1. Estas moléculas,
originan interacciones celulares y finalmente migración de
neutrófilos hacia el espacio peri celular con liberación
de enzimas (elastasas y proteasas) y radicales libres. Se
provoca así la lesión celular, tanto a nivel sinusoidal
como canalicular. A este proceso pueden contribuir aunque
en menor medida, la inducción de la síntesis de NO y la
liberación de noradrenalina intestinal. También se origina
inflamación portal, y desaparición de las proteínas de
conexión entre hepatocitos (conexinas), y contráctiles del
canalículo lo que conduce a un mayor estasis biliar.
A nivel
histológico puede observarse hiperplasia de las células de
Kupffer, infiltrados portales por mononucleares, y
obstrucción de los sinusoides hepáticos por agregados
celulares, disminuyendo el flujo sanguíneo y el área
vascular efectivos. La isquemia, y sobre todo la lesión
celular por mediadores y neutrófilos, originan en el
canalículo biliar desaparición de las vellosidades,
afectación de su mecanismo contráctil y ocupación de su
interior con material celular. Todos estos fenómenos
conducen a hipoperfusión, exfoliación endotelial,
migración de neutrófilos y finalmente apoptosis de
hepatocitos circundantes y esteatosis.
Clínica:
El
resultado final de estas alteraciones bioquímicas y
estructurales se traduce en un impedimento a la secreción
y transporte de bilirrubina, ocasionando el proceso
clínico de colestasis intrahepática. El hecho clínico más
destacado es la elevación de bilirrubina, fenómeno que
ocurre hasta en un 54% de los episodios de sepsis; hasta
en un 34% la cifra de bilirrubina es mayor de 2 mg/dl. La
hiperbilirrubinemia ocurre de manera desproporcionada al
incremento de otras enzimas como fosfatasa alcalina, GOT y
GPT. Obviamente, la elevación de bilirrubina es superior
en enfermos con hepatopatía o neoplasia previas y suele
preceder en estos casos a la aparición de cultivos
positivos. También es posible ver hiperlactacidemia por
déficit de extracción. El hígado, no solo produce
mediadores locales, sino que también modifica su síntesis
por efecto de las citokinas para sintetizar factores pro
coagulantes (PAI, fibrinógeno, PAF, trombomodulina, etc.)
y disminuir los anticoagulantes (plaquetas, AT III,
proteínas C y S, etc.. Se origina así un estado
protrombótico que contribuye importantemente a la
afectación capilar. En este hecho se basa uno de los
principales efectos beneficioso de la proteína C activada.
Diagnóstico:
Existe
controversia sobre cómo medir la disfunción hepática. Un
método consiste en el aclaramiento de sustancias como el
verde de indocianina o el MEGX. Kimura y col. en un
trabajo sobre 29 enfermos sépticos encontró que la
constante de eliminación del colorante verde de
indocianina discriminaba bien entre supervivientes y
fallecidos. Un fallo en el incremento de aclaramiento a
las 120 horas, o bien un valor extremadamente bajo a las
24 horas de ingreso, constituía un signo de mal
pronóstico. Sin embargo, para otros autores, puede haber
interferencias de este método con la presencia de
hepatopatía, su extrapolación al flujo hepático es
problemática, y la sensibilidad insuficiente del MEGX en
el enfermo crítico.
Sin
embargo, sistemas de medición por pulsioximetría como el
Liver Monitor (Pulsion Medical Systems) parecen
prometedores al ofrecer una técnica fiable de
monitorización a pie de cama. Este dispositivo mide el
aclaramiento del verde de indocianina, previa inyección
del colorante por una vía central, mediante un sistema
similar a la pulsioximetría. Los datos extraídos de este
monitor se correlacionan en enfermos críticos con la
supervivencia, incluso de manera similar al SAPS y el
APACHE II.
El
diagnóstico diferencial de la hiperbilirrubinemia es
amplio. Habitualmente en un paciente crítico habría que
considerar diversas etiologías como colecistitis
alitiásica, litiasis biliar, hepatitis farmacológica,
hemólisis y efecto de la nutrición parenteral total (NPT.
Por ello, es preciso realizar pruebas de imagen
(ecografía, TAC, pancreatografía por RMN) no siendo
habitualmente necesaria la biopsia hepática para llegar a
un diagnóstico, ya que una ecografía que muestra ausencia
de dilatación de vía biliar extrahepática, y la presencia
de signos de sepsis suele ser suficiente.
Sin
embargo, la aparición clínica puede ser tardía con
respecto al inicio de la sepsis. En este sentido Wang y
col. han demostrado mediante técnicas colorimétricas en un
modelo murino, que la disfunción celular ocurre antes del
establecimiento del síndrome de respuesta inflamatoria,
indicando que el daño hepático prioritario en la sepsis es
de naturaleza autoinmune como ya se ha comentado.
Tratamiento:
En líneas
generales no difiere del manejo general de la sepsis. Es
necesario un buen control del proceso inicial erradicando
el foco, administrando antibioterapia adecuada y
ofreciendo un buen soporte de los órganos que fracasan. No
obstante los mismos autores dudan del beneficio de una
adecuada resucitación con fluidos en la reversión de la
disfunción hepatocelular. En este sentido, una adecuada
elección de los inotrópicos puede ser importante. La
dobutamina se ha demostrado como un agente pernicioso en
modelos animales, aunque falta su confirmación en clínica
humana. También cuidar de aspectos como una adecuada
oxigenación y nutrición enteral puede ser de ayuda.
En cuanto
a las terapias de soporte específico, todavía se
encuentran en una etapa de experiencia incipiente. Existen
en el mercado diferentes soluciones para el soporte
hepático, todas ellas con ventajas e inconvenientes. En
primer lugar, sistemas celulares con función
detoxificadora y de síntesis en fase de ensayo clínico,
como el ELAD y el HepatAssist. Estos sistemas tienen el
inconveniente de su dudosa compatibilidad biológica y su
elevado coste de mantenimiento.
Los
sistemas acelulares son principalmente depuradores, y
tienen la ventaja de ser más prácticos, ya que su
funcionamiento es similar a los sistemas extracorpóreos
utilizados habitualmente en UCI. Entre ellos, el único
sistema aprobado en Europa es el sistema MARS (Molecular
Adsorbents Recirculating System), desarrollado en Alemania
en los años noventa por Stange y Mitzner. Este sistema se
basa en una diálisis con albúmina, dado que esta proteína
es el principal transportador plasmático de sustancias
como bilirrubina, ácidos biliares, cobre y aminoácidos
aromáticos.
HEMORRAGIA PULMONAR
El síndrome hemorrágico pulmonar
difuso se caracteriza por la ocupación masiva de sangre en
los espacios alveolares. Independientemente de su
etiología, las manifestaciones clínicas son similares y
consisten en una tríada clásica: hemoptisis, anemia e
imágenes de condensación pulmonar en la radiografía de
tórax.
SÍNDROME DE GOODPASTURE
Se caracteriza por la asociación de
la tríada de hemorragia pulmonar, glomerulonefritis con
insuficiencia renal progresiva y presencia de anticuerpos
antimembrana basal glomerular.
En el 75% de los casos se inicia
entre los 17 y 27 años. La forma de presentación más común
es la hemoptisis que tiende a ser recidivante y puede ser
masiva. También se observa diseña, tos y fiebre con
relación a los episodios hemorrágicos. Las anomalías del
sedimento urinario (microhematuria y cilindros) y la
proteinuria son los datos más comunes de afección renal,
aunque la insuficiencia renal aparece siempre durante el
curso de la enfermedad. La anemia ferropénica es el dato
analítico más constante. La radiografía de tórax muestra
imágenes alveolares inespecíficas en la fase de hemorragia
aguda con posible evolución posterior a patrón
intersticial, tras los brotes repetidos. El exámen
citológico de esputo al igual que el material obtenido de
un lavado broquioloalveolar muestra macrófagos cargados de
hemosiderina. La anatomía patológica es inespecífica,
observándose la hemorragia intraalveolar con los
macrófagos y a nivel renal una glomerulonefritis
rapidamente progresiva. La inmunofluorescencia revela los
depósitos de IgG en la membrana basal glomerular y/o
alveolar. Una vez establecida la sospecha diagnóstica, la
biopsia renal es el método de elección, pero dado que
muestra hallazgos inespecíficos, para su diagnóstico se
requiere de la demostración en sangre periférica de
anticuerpos. El tratamiento se basa en la plasmaféresis
asociada a citostáticos y glucocorticoides.
POLIANGITIS MICROSCÓPICA
Se caracteriza por ser una vasculitis necrotizante de
vasos pequeños (arteriolas, capilares y vénulas) con
escasos o nulos depósitos inmunes. La afección renal en
forma de glomerulonefritis necrotizante es muy frecuente y
en algunos casos cursa con capilaritis y hemorragia
pulmonar. También, aunque con menor frecuencia, puede
haber arteritis necrosante de arterias de tamaño medio y
pequeño. Cursa con manifestaciones clínicas múltiples que
incluyen dolores musculares y abdominales, hemorragias
digestivas, mononeuritis o polineuropatía, proteinuria,
hematuria, hemoptisis, infiltrados pulmonares y púrpura
palpable. La afección renal incluye una glomerulonefritis
necrosante focal con inmunofluorescencia negativa o
escasos depósitos de IgG, C3 o IgM. También puede
presentarse como una glomerulonefritis rapidamente
progresiva. La determinación de ANCA es casi siempre
positiva con un patrón perinuclear y ELISA positivo para
la mieloperoxidasa. El tratamiento incluye corticoides y
ciclofosfamida, pudiendo ser necesaria la plasmaféresis.
GRANULOMATOSIS DE WEGENER
Se caracteriza por lesiones de vasculitis necrotizante
granulomatosa que afecta varios órganos, en particular el
aparato respiratorio y los riñones. Se afectan
principalmente los pequeños vasos. Los granulomas guardan
estrecha relación con las lesiones vasculares. No hay
antecedentes de asma, alergia o exposición reciente a
fármacos. La afección respiratoria es constante y se
caracteriza por granulomas en el tabique nasal, los senos
paranasales y la nasofaringe, así como por infiltrados
pulmonares múltiples y bilaterales que a menudo cavitan.
En un 8% de los pacientes se produce hemorragia pulmonar
por capilarirtis alveolar, dando como manifestaciones
clínicas tos, diseña, dolor torácico y hemoptisis que
puede llegar a ser masiva. La afección renal es muy
frecuente (83%), aunque puedan pasar meses o años antes
que aparezcan los signos renales. Inicialmente se
manifiesta por proteinuria, hematuria y alteraciones del
sedimento, que una vez presentes la evolución hacia
insuficiencia renal es rápida e inexorable, a menos que se
instituya un tratamiento adecuado. También se acompaña de
artralgias, manifestaciones oculares y cutáneo mucosas,
siendo la más frecuente la púrpura de miembros inferiores.
El laboratorio suele presentar anemia normocítica
normocrómica, leucocitosis neutrofílica sin eosinofilia,
trombocitosis y elevación de la eritrosedimentación. De
manera característica, los ANCA son positivos con un
patrón citoplasmático (C-ANCA) y especificidad para la
proteinasa 3. La biopsia renal muestra una
glomerulonefritis necrotizante focal con proliferación
extracapilar asociada o sin ésta. El tratamiento de
elección asocia ciclofosfamida y corticoides.
LEPTOSPIROSIS
La leptospirosis es una enfermedad
zoonótica causada por una espiroqueta del género
Leptospira. Infectan una variedad de animales salvajes
y domésticos que excretan el microorganismo por su orina.
Los seres humanos infectados mediante el contacto directo
con animales infectados o de la exposición a aguas dulces
o suelos contaminados por la orina infectada del animal,
desarrollan una enfermedad febril aguda que puede seguirse
por una enfermedad más grave, en ocasiones fatal, que
puede incluir ictericia e insuficiencia renal (enfermedad
de Weil), meningitis, miocarditis, neumonitis hemorrágica
o colapso hemodinámico.
MANIFESTACIONES CLÍNICAS:
La severidad de las infecciones por
Leptospira varía de la enfermedad subclínica,
detectada por la seroconversión, a dos síndromes
clínicamente reconocibles: una enfermedad sistémica
autolimitada que se da en el 90% de los casos y una
enfermedad severa, potencialmente fatal, acompañada por
alguna combinación de insuficiencia renal, hepática y
neumonitis con diátesis hemorrágica. Ambas formas de
enfermedad progresan de una fase aguda, septicémica, a una
fase inmune de a enfermedad.
El período de incubación es de 5 a
14 días, aunque puede extenderse. La fase aguda,
septicémica, comienza de manera abrupta con fiebre de alta
intensidad, remitente (38 a 40ºC) y cefaleas (>95%);
escalofríos, rigidez y mialgias(>80%), inyección
conjuntival sin secreción purulenta, dolor abdominal,
anorexia, nauseas, vómitos, diarrea, tos y faringitis con
una duración de 3 a 7 días. También puede encontrarse
linfadenopatías y hepatoesplenomegalia. Las pruebas de
laboratorio son inespecíficas. La Leptospira pueden
recuperarse de sangre, LCR, y de la mayoría de los tejidos
durante esta fase de la enfermedad. Después de 5 a 7 días
pueden recuperarse leptospiras de la orina. El análisis de
orina muestra proteinuria, con hematuria o sin ella,
cilindros hialinos y granulosos.
La defervescencia de la enfermedad,
anuncia la fase inmune, que se prolonga de 4 a 30 días. La
producción de anticuerpos IgM aglutininas opsonizantes es
responsable de la disminución de la fiebre de corta
duración de 1 a 3 días y de la desaparición de las
leptospiras de la sangre y del LCR. Los hallazgos clínicos
prominentes incluyen inyección conjuntival, mialgias,
adenopatías y hepatoesplenomegalia.
La enfermedad de Weil, caracterizada
por daño de la función hepática y renal, es una forma
severa que puede desarrollarse después de una fase aguda
de la enfermedad, pudiendo evolucionar con rapidez con
fiebre superior a 40ºC, insuficiencias hepática y renal,
neumonitis hemorrágica, arritmia cardíaca o colapso
circulatorio.
La ictericia es el resultado
típico de la lesión vascular en los capilares hepáticos en
ausencia de necrosis hepatocelular. Después de la fase
aguda, los niveles de bilirrubina sérica si bien se
encuentran aumentados, no suelen superar los 20 mg/dl,
alcanzando su máximo valor el día 7 en el 85% de los
pacientes. La hepatoesplenomegalia se presenta en más del
25% de los pacientes ictéricos. Con la progresión a la
enfermedad severa causada por la isquemia más extensa, los
niveles séricos de bilirrubina conjugada pueden elevarse a
los 80 mg/dl, acompañados por elevaciones modestas en los
niveles de fosfatasa alcalina. Los niveles de
transaminasas raramente exceden las 200 UI/ml, la
hipoprotrombinemia es rara y generalmente responde a la
administración de vitamina K. Los niveles de
creatinafosfocinasa están elevados de manera típica, fuera
de proporción con las transaminasas. En la necropsia,
los hepatocitos muestran cambios degenerativos leves,
hipertrofia e hiperplasia de las células de Kupffer,
eritrofagocitosis y colestasis; la necrosis focal, cuando
se presenta no se acompaña de ruptura zonal de la
arquitectura hepática.
La insuficiencia renal aguda
se caracteriza por un comienzo rápido de uremia y oliguria
durante la segunda semana de la enfermedad, con frecuencia
acompañada de ictericia. Los niveles de urea suelen ser
menores de 100 mg/dl y el nivel de creatinina sérica por
debajo de 2 a 8 mg/dl durante la fase aguda de la
enfermedad, pero los niveles pueden exceder los 300 y 18
mg/dl respectivamente. La trombocitopenia ocurre en
ausencia de coagulación intra vascular diseminada y puede
acompañar a la disfunción renal progresiva. La biopsia
renal revela nefritis intersticial aguda, también puede
presentarse glomerulonefritis por complejos inmunes. La
deshidratación concomitantemente que causa hipovolemia e
hipotensión complica la lesión renal. El desarrollo de
anuria es un signo de mal pronóstico. En las necropsias
los riñones se encuentran tumefactos y amarillos con vasos
sanguíneos corticales prominentes. Desde un punto de vista
histológico, un infiltrado inflamatorio tubulointersticial
difuso, mixto, constituido por linfocitos, células
plasmáticas, macrófagos y polimorfonucleares se acompaña
por áreas focales de necrosis tubular.
La neumonitis hemorrágica
severa y el síndrome de dificultad pulmonar agudo pueden
ser manifestaciones prominentes de infección y pueden
ocurrir en ausencia de insuficiencia renal o hepática. De
manera simultánea puede originarse una hemoptisis franca
con el comienzo de tos durante la fase aguda de la
enfermedad; la auscultación puede ser normal. Con el
compromiso pulmonar progresivo se observan anormalidades
radiográficas, con más frecuencia en los lóbulos
inferiores, que evolucionan de densidades pequeñas
nodulares a infiltrados pulmonares en placas, la
consolidación confluente es poco habitual. En la
necropsia, los pulmones presentan una congestión
macroscópica y demuestran áreas focales de hemorragia.
Desde el punto de vista histológico, el daño del endotelio
capilar conduce a la congestión con focos de hemorragia
intersticial e intraalveolar, daño alveolar difuso y
desorganización severa de los espacios aéreo; es
característico que los infiltrados inflamatorios estén
ausente.
La insuficiencia cardiaca
congestiva ocurre en raras ocasiones. Sin embargo son
comunes los cambios electrocardiográficos inespecíficos.
El colapso cardiovascular con shock puede aparecer
de manera abrupta, pudiendo ser fatal. En la necropsia
se observa miocarditis intersticial con compromiso
inflamatorio del sistema de conducción, aortitis y
arteritis coronarias.
DIAGNOSTICO DE LABORATORIO
El aislamiento de leptospiras de
muestras clínicas de seres humanos es el “gold estándar”.
Sin embargo el aislamiento puede ser difícil y requerir
hasta 16 semanas en laboratorios especializados.
Las leptospiras pueden aislarse de
sangre, orina y LCR durante los primeros 7 a 10 días de
enfermedad y de la orina durante la segunda y tercer
semana.
Métodos de detección indirectos:
La prueba serológica estándar para la
detección de anticuerpos contra la Leptospira es la micro
aglutinación que emplea microorganismos vivos. El caso
confirmado se define por el aumento de cuatro veces o más
en el título MAT entre las muestras de suero en la fase
aguda y de convalecencia. Un título de por lo menos 1:800
en presencia de síntomas compatibles es una evidencia
sólida de infección reciente o actual y un título de 1:200
o dos consecutivos de 1:200 es sugestivo. De manera
alternativa se dispone de hemoaglutinación y ELISA para
detectar IgM.
Métodos de detección directos:
La microscopía de campo oscuro puede
proporcionar un diagnóstico presuntivo. También por
inmunohistoquímica, PCR para la detección del ADN de
Leptospira.
TRATAMIENTO
Varios estudios controlados
con placebo, demostraron la eficacia clínica del
tratamiento con penicilina endovenosa en la enfermedad
tardía y severa y amoxicilina, ampicilina, tetraciclinas y
doxiciclina por vía oral para las infecciones leves.
DIAGNÓSTICOS PROBABLES:
1.
Falla multiorgánica por leptospirosis
2.
Shock séptico de probable origen abdominal
|
|
|
Discusión |
La discusión de este seminario se
llevó a cabo el jueves 26 de mayo, y
estuvo a cargo del
Dr. Gastón Chiganer.
El archivo de la presentación multimedia
de esta discusión, se encuentra
disponible para ser descargado.
Descargar
Archivo PWP /
279 Kb |
|
| |
|
Imágenes |
 |
|
|
|
Clic para ampliar |
|
|
| |
|
|
|
|
|