Discusión del caso clínico. | Presentación | Evolución |
Procedo a la discusión del caso de un varón con HIV/SIDA que se presenta a la consulta con mialgias generalizadas, impotencia funcional y fiebre.
Tomando como dato guía las mialgias, me propongo los siguientes objetivos:
• Revisar la causas de mialgia
• Considerar los diagnósticos diferenciales atribuibles a nuestro paciente
• Considerar opciones de estudio y tratamiento
Si abarcamos la generalidad del tema, el abanico de diagnósticos diferenciales es muy grande, por lo que me voy a enfocar en nuestro paciente caso que presenta, infección por VIH en tratamiento irregular con zidovudina, atazanavir, ritonavir y lamivudina , y una historia de bacteriemia recurrente por Staphylococcus Aureus meticilino resistente (SAMR) con múltiples internaciones previas. En este caso, se presenta con el cuadro clínico antedicho y presenta además, leucocitosis, reactantes de fase aguda elevados, CPK normal y aislamiento de SAMR en urocultivo y hemocultivos (2/2) con buena respuesta al tratamiento con vancomicina. De esta manera, las posibilidades diagnósticas se reducen a dos grupos de patologías: las miopatías tóxicas y las miopatías infecciosas.
Miopatías por fármacos
Constituyen el grupo de miopatías más frecuentes, aunque sólo excepcionalmente presentan gran expresión clínica. Se deben sospechar en casos de elevación sérica de CPK y/o desarrollo de mialgias en un paciente que se halla bajo un tratamiento farmacológico. Se trata de una miopatía tóxica pero no necesariamente de miositis. Las únicas excepciones son las miositis causadas por d -penicilamina, la zidovudina (AZT) y ácido 13 cis -retinoico.
Por lo general producen mialgias y debilidad muscular de tipo proximal pero raras veces impide la deambulación o afectan la musculatura respiratoria. La complicación más temible de cualquiera de estas miopatías es el desarrollo de rabdomiolisis y mioglobinuria por el posible fracaso renal agudo que pueden condicionar.
Debido a que nuestro paciente recibe desde hace varios años tratamiento con AZT, la miopatía causada por los inhibidores nucleósidos de la transcriptasa inversa (INTI) es uno de los diagnósticos diferenciales a considerar. Se trata de una lesión la de fibra muscular por inhibición de la síntesis de ADN mitocondrial inducida por los INTI. Guarda clara relación con la dosis total acumulada del fármaco, (alrededor de 200g) aunque no todos los enfermos la desarrollan y algunos pacientes que presentan cambios histológicos típicos se hallan asintomáticos. Fue originalmente descripta para la zidovudina (AZT) en tiempos en que las dosis utilizadas eran mucho mayores a las usadas en la actualidad. Otros INTI (tenofovir, abacavir, emtricitabina y lamivudina) no se han asociado con miopatía. Clínicamente se manifiesta en forma de debilidad muscular proximal, en ocasiones con mialgias, puede haber atrofia muscular y moderada o nula elevación de la CK sérica. Puede coexistir con otras miopatías relacionadas con el VIH (miopatía nemalínica, microvasculitis o polimiositis), por lo que en ocasiones es difícil atribuir a una causa u otra la debilidad muscular que puede presentar un enfermo con infección por el VIH que recibe tratamiento con AZT. La electromiografía puede ser normal o mostrar cambios compatibles con una miopatía leve. La biopsia muscular muestra una forma característica de necrosis de fibras musculares (fibras deshilachadas de color rojo) y grado variable de atrofia. No muestra generalmente infiltrado inflamatorio. Se ha demostrado que responde bien a la suspensión del fármaco, revirtiendo los cambios en 1 a 2 meses en forma completa, pudiendo utilizarse glucocorticoides sistémicos mientras se espera respuesta.
Si bien la miopatía por INTI es posible en nuestro paciente, la considero poco probable dado el inadecuado cumplimiento del tratamiento, la predominancia del dolor sobre la debilidad muscular en el cuadro clínico del paciente y la reversibilidad sintomática aún sin la suspensión del fármaco.
Miopatías infecciosas
El segundo grupo de miopatías a considerar lo constituyen las miopatías infecciosas que pueden incluir virus, bacterias y enfermedades por parásitos.
Aunque numerosas infecciones virales pueden producir mialgias, no son auténticas miositis, ya que no se ha podido demostrar la existencia de RNA o DNA víricos por biología molecular en los casos en que se han practicado biopsias. La excepción la constituyen los retrovirus HIV-1 y HTLV-1, en cuya infección sí se ha demostrado la existencia de polimiositis.
1-Miopatís Virales: por VIH
Se manifiesta con mialgias y debilidad muscular proximal y simétrica con predilección por las extremidades inferiores (similar a PM idiopática). Puede manifestarse en cualquier momento de la enfermedad siendo la manifestación de presentación de la infección por VIH, o producirse en el contexto de SIDA ya establecida. No se correlaciona con el grado de inmunosupresión o el nivel de células T CD4+ en la circulación. Puede estar presente en un 0,2% de los pacientes con VIH. La patogénesis de la miositis VIH no se ha establecido pero se sugiere que podría deberse a la invasión directa por parte del virus que actuaría en forma transitoria sobre las células musculares desencadenando un mecanismo inmunológico mediado por células o una combinación de ambos mecanismos. El diagnóstico de la miositis por VIH representa un desafío diagnóstico para diferenciarla de la toxicidad por AZT. Las enzimas musculares aumentan hasta 10 veces. En la electromiografía aparecen cambios miopáticos con fibrilaciones y potenciales polifásicos característicos de la irritabilidad de la membrana. No se distinguen de PM idiopática. La biopsia muscular muestra un infiltrado de células mononucleares, predominantemente linfocitos T CD8+ y macrófagos en el endomisio.
Considero probable el diagnóstico de miositis por VIH en nuestro paciente.
2-Miositis parasitarias: toxoplasmosis
Diversos parásitos pueden asentar en el músculo estriado y provocar reacciones inflamatorias focales o difusas. Así sucede en la toxoplasmosis, la cisticercosis y la triquinosis. La primera de ellas se ha descrito en enfermos infectados por el VIH.
Debe considerarse la posibilidad de miositis parasitarias en los enfermos con mialgias difusas, en especial si se acompañan de eosinofilia en sangre periférica y/o existen antecedentes epidemiológicos de ingesta de carne de cerdo cruda o poco cocida o de viajes a zonas con alta prevalencia de enfermedades parasitarias.
En la toxoplasmosis, en general existe un cuadro previo de infección de las vías respiratorias altas y de poliadenopatías. Se presenta con m ialgia, debilidad y pérdida de masa muscular difusa (similar a las miopatías por VIH e INTI). Es frecuente su asociación con toxoplasmosis en sistema nervioso central. Las enzimas musculares pueden o no estar elevadas. La serología es positiva y en la b iopsia muscular puede observarse necrosis y grado variable de inflamación, por lo general con más neutrófilos que en miopatía VIH, siendo confirmatorio el hallazgo de quistes intracelulares con T. gondii. Dado que la miositis por toxoplasmosis responde a la terapia antibiótica adecuada (pirimetamina + sulfadiazina), es importante considerar este diagnóstico en pacientes infectados por el VIH que se presentan con miopatía.
En el caso de nuestro paciente, la miositis por toxoplasma queda descartada por presentar IgG positiva en títulos bajos e IgM negativa.
Miopatías bacterianas
Estas miositis se producen como consecuencia de la localización bacteriana muscular a partir de un foco infeccioso próximo o tras una diseminación hematógena (formas primarias). Las lesiones pueden ser únicas o múltiples y en muchas ocasiones existen antecedentes de traumatismo previo.
3-Miositis tuberculosa
Muy poco frecuente en la actualidad, afecta un músculo o grupo muscular cercano a un foco tuberculoso (espondilodiscitis). En ocasiones adopta una forma nodular única y son excepcionales los cuadros de polimiositis generalizada.
Si bien no es posible descartar tuberculosis pulmonar en nuestro paciente, considero poco probable una miositis tuberculosa.
4-Piomiositis
La miositis por Staphylococcus aureus es la más común (90% en piomiositis tropicales y hasta 75% en piomiositis no tropicales). Progresivamente viene cobrando importancia debido al creciente aumento de Staphylococcus aureus meticilino resistente ( SAMR) de la comunidad en nuestro país. Se caracteriza por la formación de abscesos musculares únicos o múltiples en el interior del músculo. Se la denominó piomiositis tropical por darse con mayor frecuencia en los trópicos donde es endémica (1-4%), aunque puede verse en países de clima frío o templado, conocida como piomiositis no tropical 1-3.
El Estreptococo betahemolítico del grupo A es el segundo agente etiológico en frecuencia. Produce una forma de miositis denominada "fulminante" por su forma clínica de presentación, con mialgias intensas y gran incapacidad funcional, edema y tumefacción de los músculos afectos, sin crepitación. Moderada o nula elevación de las enzimas musculares. Los pacientes fallecen por shock séptico en 2-3 días si no se inicia de forma temprana el tratamiento antibiótico específico.
Menos comunes son las miositis causadas por neumococos, enterobacterias Gram (-) y micobacterias. También pueden ser polimicrobianas, particularmente en pacientes diabéticos.
Los factores predisponentes para padecer una miositis bacteriana son múltiples: la i nmunodeficiencia, principalmente la del paciente con VIH/SIDA constituye un factor de riesgo muy importante por el compromiso inmunológico, la posibilidad de asociarse miopatías previas como la miopatía primaria producida por el mismo virus, la terapia antirretroviral (AZT), el aumento de la tasa de colonización por estafilococos y otras como la toxoplasmosis que pueden coexistir y que predisponen al daño muscular y alteración de la inmunidad local; los traumatismos son un factor de riesgo importante sobre todo en pacientes inmunocompetentes, produciéndose hematomas en los que la acumulación de hierro predispone a crecimiento bacteriano actuando como medio de cultivo; la administración de drogas por vía parenteral favorece la diseminación bacteriana hematógena; y otras formas de inmunocompromiso como la malnutrición, diabetes mellitus y/o enfermedades hematológicas también constituyen factores de riesgo.
Etapas clínicas de la miositis estafilocóccica:
• Etapa invasiva: cuadro subagudo. Dolor local, calambres musculares (leñoso), hinchazón, con o sin eritema y fiebre de bajo grado. Sin fluctuación. Leucocitosis leve. Sólo el 2% de los diagnósticos se realizan durante esta etapa.
• Etapa supurativa: de 10 a 21 días después del inicio de los síntomas. Fiebre, exquisita sensibilidad muscular y edema. Generalmente sin eritema. Absceso puede ser clínicamente aparente. Leucocitosis marcada. Más del 90% se presentan en esta etapa supurativa.
• Etapa toxicidad sistémica: músculo fluctuante y eritematoso. Pueden ocurrir complicaciones de bacteriemia por S. aureus (shock séptico, endocarditis, émbolos sépticos, insuficiencia renal aguda).
Los músculos que se afectan con mayor frecuencia son los cuádriceps, los glúteos y la musculatura axial. El cuadro clínico es subagudo y cursa siempre con sintomatología local de dolor, tumefacción e impotencia funcional; su diagnóstico es fácil. Es frecuente encontrar leucocitosis neutrofílica y reactantes de fase aguda elevados, con CPK normal salvo en los casos con rabdomiolisis severa . El diagnóstico se confirma mediante cultivo de material aspirado del músculo y hemocultivos, éstos últimos son positivos en un 35-57% de los casos. Los métodos de diagnóstico por imágenes son de gran ayuda para establecer el grado de compromiso muscular, inicialmente se puede solicitar una ecografía del musculo doloroso y luego tomografía computada o una resonancia magnética que supera a los otros métodos en la visualización del proceso inflamatorio/infeccioso y de colecciones líquidas a nivel del músculo.
El pronóstico suele ser bueno y está claramente relacionado con el momento del diagnóstico. La mortalidad es más elevada en las piomiositis no tropicales (10%) que en las tropicales (2%).
El tratamiento consiste en antibioterapia combinada y drenaje de abscesos por punción guiada o quirúrgico . La antibioticoterapia varía según se trate de pacientes inmunocompetentes, en los que habrán de cubrirse estafilococos y estreptococos teniendo en cuenta el SAMR en paciente con un episodio previa demostrada por este microorganismo, pacientes con factores de riesgo para SAMR y pacientes con toxicidad sistémica ; o inmunocomprometidos en los que deberá ampliarse la cobertura a gérmenes gran positivos y negativos y anaerobios. La duración de la terapia será d e 3 a 4 semanas de terapia parenteral, más prolongada en pacientes con infección extensa, multifocal o drenajes incompletos, ajustando también en caso de complicaciones de bacteriemia (endocarditis u osteomielitis). La infección recurrente es rara, pero se ha descrito en individuos inmunocomprometidos.
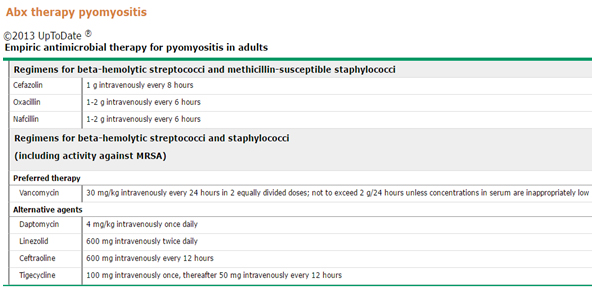

Teniendo en cuenta la forma de presentación clínica de nuestro paciente y su respuesta al tratamiento, considero que padece una miositis bacteriana causada por staphylococcus aureus meticilino resistente consecuencia de una bacteriemia persistente por dicho germen. Lo que me pregunto en este punto es cuál es el foco que actúa como reservorio del germen. La forunculosis es sin dudas el primero en ser considerado, y teniendo en cuenta que tanto en las internaciones previas como en la actual se ha descartado una espondilodiscitis que actúa frecuentemente como punto de partida para las bacteriemias, me pregunto si una endocarditis o una prostatitis crónica a SAMR (recordemos que en su última internación presentó un cuadro prostático y también ahora presenta síntoma urinarios y urocultivo positivo para SAMR) podrían constituir un foco infeccioso persistente.
Es bien sabido que la colonización por SAMR puede asentar sobre la mucosa nasal, orofaringe, epidermis íntegra, úlceras crónicas cutáneas, heridas en fase de cicatrización o en la uretra de portadores de sonda. Sin embargo, no he encontrado bibliografía que indique a la próstata como lugar de colonización. En las p rostatitis agudas m uy raramente hay abscesos por Staphylococcus aureus que llegan por vía hematógena. En el caso de las p rostatitis crónicas, la P. aeruginosa y el S. aureus se hallan con frecuencia en pacientes con antecedentes de hospitalización y/o sondaje vesical. Los pacientes con dicho cuadro pueden tener síntomas de infección urinaria aguda (principal causa de infección urinaria recurrente en el varón), molestias perineales, dolor lumbar o ser asintomática. El diagnóstico etiológico de una prostatitis puede hacerse mediante urocultivos seriados antes y después de masaje prostático. El t ratamiento de prostatitis crónica suele ser difícil y es frecuente la recidiva debido a la poca penetrancia antibiótica en la próstata no inflamada, a la presencia de bacterias acantonadas en pequeños abscesos, cálculos prostáticos o en biofilms. La antibioticoterapia debe ser dirigida según sensibilidad del germen teniendo en cuenta la penetrancia en próstata. Se prefiere una fluoroquinolona por vía oral durante 4-12 semanas, obteniéndose un 60-80% de curación en 1-3 meses. El porcentaje de éxitos con cotrimoxazol es menor con 4 semanas de tratamiento (50% de recidivas) por lo que se recomienda durante 3 meses. Se debe realizar un urocultivo de control a los 15 días y a los 6 meses de terminado el tratamiento antibiótico.
Aunque el foco dérmico se constituye como el más probable para una bacteriemia persistente en nuestro paciente, no descarto la necesidad de realizar diagnóstico de prostatitis crónica por SAMR.
Considero indispensable el tratamiento de la bacteriemia además del de la miositis bacteriana, por dicho motivo he revisado las últimas actualización referidas al tema. Una publicación reciente del Journal of Infection and Chemotherapy indica que la v ancomicina sigue siendo el tratamiento de primera línea para infecciones severas por SARM. Por su parte, la daptomicina ha demostrado no ser inferior a la vancomicina y podría ser considerada en tratamiento empírico de bacteriemia o endocarditis infecciosa (EI) a altas dosis (8 – 10 mg/kg/día). En casos de intolerancia a vancomicina, se debe considerar la teicoplanina como terapia alternativa para la bacteriemia y endocarditis infecciosa por SAMR. En dicha revisión, queda claro que no deben ser usados en bacteriemia o EI, especialmente en forma empírica, aquellos fármacos que han demostrado ser inferiores a la vancomicina y con un mayor riesgo de fracaso con el tratamiento, como es el caso de la clindamicina, la trimetroprima-sulfametoxazol (TMP-SMX) y la tigeciclina.

Para finalizar la discusión sugiero continuar el tratamiento con vancomicina en forma endovenosa por un mínimo de 4 semanas para luego pasar a TMP-SMX por vía oral por tiempo indeterminado.
Evaluar la necesidad de requerimiento quirúrgico en caso de evidenciarse colecciones musculares francas o su drenaje por punción guiada. Por otra parte, es mandatoria la realización de ecocardiograma para descartar endocarditis infecciosa, como así también otros exámenes complementarios que permitan descartar focos infecciosos activos que puedan perpetuar la bacteriemia.
Por último, siendo nuestro paciente caso muy poco adherente a las indicaciones médicas, creo que es preciso un abordaje interdisciplinario que mejore el resultado de los tratamientos instituidos.
Bibliografía
Arzu Karli, Keramettin Yanik. Infección diseminada por Staphylococcus aureus positivo para leucocidina de Panton-Valentine en un niño. - Arch Argent Pediatr 2016; 114(2):e75-e77/e75, disponible en http://www.scielo.org.ar/pdf/aap/v114n2/v114n2a14.pdf
Cervantes García Estrella, García González Rafael, Salazar Schettino Paz María - Staphylococcus aureus asociado a la comunidad (CA-MRSA). Revista Latinoamericana de Patología Clínica; disponible en http://www.medigraphic.com/pdfs/patol/pt-2015/pt152f.pdf
Farreras - Rozman. Medicina interna. 14° edición. Sec. 12- Neurología. Cap. 205: Enfermedades musculares 1770-1785.
García-Arenzan,a Anguera JM. Tratamiento de las prostatitis - Información Terapéutica del Sistema Nacional de Salud Español, Nº 6-2005, Vol 29: 145-151; disponible en http://www.msssi.gob.es/biblioPublic/publicaciones/docs/vol29_6Prostatitis.pdf
Johnson RW, Williams FM, Kazi S, Dimachkie MM, Reveille JD. Human immunodeficiency virus-associated polymyositis: A longitudinal study of outcome. Arthritis Rheum. 2003; 49(2):172–178; disponible en https://www.ncbi.nlm.nih.gov/pubmed/12687507
Liu Catherine, Bayer Arnold and col. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus Aureus Infections in Adults and Children - Clinical Infectious Diseases Advance Access published January 4, 2011, disponible en http://cid.oxfordjournals.org/content/early/2011/01/04/cid.ciq146.full.pdf+html
Mical Paul, Jihad Bishara, Dafna Yahav. Trimethoprim-sulfamethoxazole versus vancomycin for severe infections caused by meticillin resistant Staphylococcus aureus: randomised controlled trial - BMJ. 2015; 350: h2219; disponible en http://www.bmj.com/content/bmj/350/bmj.h2219.full.pdf
Robinson-J Papp , Simpson DM – Neuromuscular diseases associated with HIV-1 infection. Muscle Nerve 2009 Dec; 40 (6): 1043-1053; disponible en https://www.ncbi.nlm.nih.gov/pubmed/19771594
Sáez-Jiménez R., Almodóvar-González R. Mujer de 53 años con fiebre, dolor y tumefacción en hemitórax derecho - Archivos en Medicina Familiar 2006; Vol. 8 (3)- 197-199, disponible en http://www.medigraphic.com/pdfs/medfam/amf-2006/amf063i.pdf
Shallcross LJ, Fragaszy E, Johnson AM, Hayward AC. The role of the Panton-Valentine leucocidin toxin in staphylococcal disease: a systematic review and meta-analysis. Lancet. 2013;13(1):43–54, disponible en http://www.thelancet.com/pdfs/journals/laninf/PIIS1473-3099(12)70238-4.pdf
Stephen D. Lawn, Tihana A. Bicanic and Derek C. Macallan - Pyomyositis and Cutaneous Abscesses Due to Mycobacterium avium: An Immune Reconstitution Manifestation in a Patient with AIDS. Clinical Infectious Diseases 2004; 38:461–3; disponible en http://cid.oxfordjournals.org/content/38/3/461.full.pdf+html
Subirá Carolina, Laurenti Maria de las Nieves y colaboradores - Osteomielitis como complicación de piomiositis por estafilococo meticilino resistente de la comunidad en paciente inmunocompetente. Anuario Fundación Dr. J.R. Villavicencio, 2010 Nº XVIII 182-185; disponible en http://www.villavicencio.org.ar/PORTAL/index.php?sis=2&ubq=4&scc=11&men=34&anu=2010
UpTo Date 21.2, Robert H Shmerlinn- Approach to the patient with mialgia.
UpTo Date 21.2, Marc L Miller – Muscle disease in HIV-infected patients.
UpTo Date 21.2, Marc L Miller – Drug-induced myopathies.
UpTo Date 21.2, Kees Brinkman - Mitochondrial toxicity of HIV nucleoside reverse transcriptase inhibitors.
UpTo Date 21.2, Larry M Baddour - Pyomyositis.
UpTo Date 21.2, Vance G Fowler, Jr, Daniel J Sexton - Complications of Staphylococcus aureus bacteremia.
UpTo Date 21.2, Deverick J Anderson - Epidemiology of methicillin-resistant Staphylococcus aureus infection in adults.
VanEperen Alison S., Segreti John. Empirical therapy in Methicillin-resistant Staphylococcus Aureus infections: An Up-To-Date approach - Journal of Infection and Chemotherapy xxx (2016) 1e9; disponible en http://fulltext.study/download/3376620.pdf
|