Discusión del caso clínico. | Presentación | Evolución |
Como objetivos de mi discusión planteo:
- Describir el abordaje y las diferentes causas de la insuficiencia renal aguda(IRA).
- Analizar las probables causas de IRA en nuestro paciente.
- Describir las manifestaciones renales de la tuberculosis.
- Comentar generalidades del tratamiento de la IRA.
- Realizar consideraciones finales.
Introducción
Definición: El fracaso renal agudo (FRA) es un síndrome clínico, secundario a múltiples etiologías, que se caracteriza por un deterioro brusco de la función renal, cuya expresión común es un aumento de la concentración de los productos nitrogenados en sangre, con/sin disminución del volumen urinario”.
No existe una definición universal de insuficiencia renal aguda. En general, todas las definiciones subrayan el carácter inmediato del deterioro funcional renal y la importancia del descenso brusco del filtrado glomerular y/o la elevación de los productos nitrogenados en sangre, como marcador universal de la insuficiencia renal aguda independiente de su etiología. Ante esta disparidad de criterios, en la última década se han formado diferentes grupos de estudio para desarrollar recomendaciones consensuadas y guías clínicas basadas en la evidencia sobre el tratamiento y prevención de la insuficiencia renal aguda. Reconocen la necesidad de unificar la definición del FRA, pero hasta la fecha sólo han consensuado diferentes clasificaciones funcionales.
Sistema RIFLE
Se desarrolló durante la Segunda Conferencia de Consenso de ADQI celebrada en Vicenza en 2004. RIFLE es el acrónimo de las palabras inglesas correspondientes a riesgo (risk), daño (injury), fallo (failure), pérdida prolongada de función renal (loss) y fallo final e irreversible de la función renal (end). Por tanto, incluye tres etapas de lesión renal y gravedad creciente (risk-injury-failure) y dos de pronóstico clínico (loss-end).
Los parámetros utilizados para estratificar la lesión renal aguda son descensos porcentuales del filtrado glomerular, elevaciones relativas de la creatinina sérica con respecto a un valor basal y el descenso de la diuresis . Tiene en cuenta la presencia de insuficiencia renal crónica previa, así aquellos pacientes con valores de creatinina sérica >4 mg/dl son considerados en estadio F, siempre que el aumento haya sido de, al menos, 0,5 mg/dl.
Para clasificar a un paciente se debe utilizar el peor criterio (creatinina, filtrado glomerular o diuresis) que le sitúe en un mayor estadio de gravedad. El período de tiempo considerado para evaluar los cambios es de 7 días.
Esta clasificación ha demostrado ser útil para diagnosticar la insuficiencia renal aguda y clasificar a los pacientes según su gravedad funcional, pero también ha demostrado su correlación como marcador pronóstico.
Clasificación AKIN
Es una modificación del sistema RIFLE, propuesta por la Acute Kidney Injury Network. Se fundamenta en la aparición de nuevos datos epidemiológicos que demuestran un incremento del 80% en el riesgo de mortalidad con cambios tan mínimos en la concentración de creatinina sérica como de 0,3 a 0,5 mg/dl. En lugar de utilizar las letras de un acrónimo emplean un sistema de estadios funcionales identificados por números que se corresponden con los tres primeros estadios del RIFLE. Por tanto, sólo hay dos diferencias entre ambos sistemas: la clasificación AKIN incluye en su estadio 1 pequeños incrementos de la creatinina sérica (0,3 mg/dl) y los cambios observados en la función renal deben producirse en 48 horas.
Añaden dos premisas:
- Los criterios diagnósticos únicamente deben aplicarse después de optimizar el estado de volemia del paciente.
- Cuando sólo consideremos la oliguria como criterio diagnóstico, previamente se debe descartar la existencia de uropatía obstructiva.
En este entonces se acuña el término Lesión Renal Aguda (LRA) que ha reemplazado al de insuficiencia renal aguda para poner de relieve que existe una lesión continua que comienza mucho antes de que la pérdida suficiente de la función excretora renal pueda ser medida mediante los análisis de laboratorio estándar. El término también indica un continnum pronóstico, asociado incluso a pequeños aumentos en la creatinina sérica y aumentos adicionales de la mortalidad a medida que aumenta la creatininemia.
Por su universalidad, bajo costo y frecuencia de uso, la determinación de creatinina ha sido el patrón utilizado para la práctica clínica en el diagnóstico y tratamiento de la insuficiencia renal aguda. Sin embargo, adolece de varios inconvenientes: se eleva cuando el filtrado glomerular ha descendido a la mitad; su concentración se ve muy influida por los cambios en la masa muscular, por el aumento de la secreción tubular en presencia de deterioro funcional y por numerosos factores extrarrenales (peso corporal, raza, edad, sexo). En resumen, el filtrado glomerular por el aclaramiento de creatinina no parece una herramienta exacta en situaciones metabólicas inestables como las que acompañan a la insuficiencia renal aguda.
Nuevos Biomarcadores
Los investigadores han usado nuevas técnicas de investigación proteómicas para identificar a varios biomarcadores de daño renal nuevos tales como cistatina C, B2 microglobulina, lipocalina asociada agelatinasa de neutrófilo-NAGL. Estos aún se encuentran en investigación sin utilidad clínica.
Ante todo deterioro de la función renal, debemos poder distinguir ante qué tipo de insuficiencia renal nos encontramos, y al mismo tiempo, intentar descubrir su etiología.
Para ello, nos apoyaremos en la realización de una historia clínica detallada ,una exploración física minuciosa y la utilización de las diferentes pruebas diagnósticas complementarias de forma escalonada en función de su eficacia e inocuidad para el enfermo.
Debemos abordar el diagnóstico diferencial del FRA desde cuatro puntos de vista:
- Diagnóstico sindrómico, ¿deterioro agudo o crónico?
- Diagnóstico funcional, ¿cuánto se ha deteriorado la función renal?
- Diagnóstico fisiopatológico, ¿prerrenal, parenquimatoso, obstructivo?
- Diagnóstico etiológico, ¿qué causa lo produce?.
La primera pregunta que debemos plantearnos es si nos encontramos ante un caso de insuficiencia renal crónica o de FRA. La distinción entre estas dos situaciones, en ocasiones, resulta difícil. Inicialmente, deberemos averiguar la posible existencia de controles analíticos previos de la función renal obtenidos en controles rutinarios, o bien por procesos patológicos anteriores, que nos permitan conocer si el deterioro actual es agudo o crónico, así como conocer antecedentes personales o familiares de enfermedad renal .
Nuestro paciente presentaba un laboratorio con función renal normal hace 4 meses por lo que estamos frente a una falla renal aguda.
Para el diagnóstico funcional podemos utilizar cualquiera de las clasificaciones comentadas previamente (RIFFLE ,AKIN).
Diagnóstico fisiopatológico
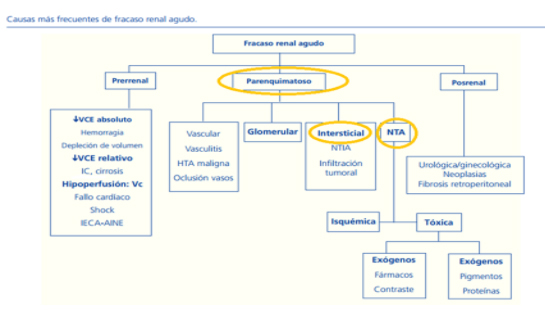
FIGURA 1: Diagnóstico diferencial de la insuficiencia renal aguda M.T. Tenorio, C. Galeano, N. Rodríguez, F. Liaño NefroPlus 2010;3(2):16-32.
Clásicamente,desde un punto de vista fisiopatológico , la FRA se ha clasificado en prerrenal , renal y postrenal .
FRA prerrenal
Aparece como consecuencia de multitud de procesos que conduzcan a la disminución de la perfusión renal.
Hipovolemia verdadera: la depleción de volumen intravascular verdadera puede ser secundaria a pérdidas sanguíneas, digestivas, renales, aumento de las pérdidas insensibles o incluso la escasa ingesta de alimentos. Puede ocurrir también como consecuencia de su paso al espacio intersticial como sucede en el síndrome nefrótico, la malnutrición, la pancreatitis, la peritonitis o el síndrome por aplastamiento.
Hipovolemia efectiva: la disminución del volumen circulante eficaz con volumen intravascular conservado o incluso aumentado puede aparecer en el seno de patologías cardíacas (insuficiencia cardíaca, arritmias, taponamiento cardíaco), patologías pulmonares que afectan al gasto cardíaco (Tromboembolismo pulmonar, Hipertensión pulmonar) o fenómenos que produzcan vasodilatación sistémica y alteración de la permeabilidad vascular (hepatopatía, sepsis, shock anafiláctico, hipoxemia, síndrome de hiperestimulación ovárica y fármacos como la IL-2 o el IFN).
Vasoconstricción renal: la caída de la perfusión renal se puede producir como consecuencia de la vasoconstricción directa de la circulación renal. Esto ocurre en procesos como el síndrome hepatorrenal, la sepsis, el uso de sustancias alfaadrenérgicas y la hipercalcemia.
Adaptación de las respuestas adaptativas renales: los mecanismos que intentan compensar la disminución de la presión de perfusión renal mediante la vasodilatación de la arteria aferente y la vasoconstricción de la arteria eferente se pueden ver interferidos a uno u otro nivel o a ambos. La causa fundamental es el uso de fármacos, siendo éstos un desencadenante cada vez más frecuente de FRA prerrenal.
FRA postrenal
Aparece como consecuencia de causas obstructivas a diferentes niveles y de múltiples etiologías (tumores ,litiasis ,hiperplasia prostática ,etc).
Nuestro paciente no presenta ninguna causa clínica ,analítica ni imagenológica para presentar una IRA prerrenal o postrenal por lo que nos abocaremos en detalle a la causa de falla renal intrínseca.
FRA renal
Necrosis tubular aguda (NTA)
Es la causa más frecuente de FRA parenquimatosa en general y de forma específica en los pacientes hospitalizados. Obedece al daño estructural de las células tubulares, del componente intersticial y de la microvasculatura renal. Estas alteraciones están condicionadas fundamentalmente por dos tipos de mecanismos:
-Por isquemia prolongada en el caso de la NTA isquémica.
- Por tóxicos en el caso de NTA nefrotóxica.
Se reconocen cinco estadios fisiopatológicos en el curso de la NTA :
1. Agresión hemodinámica o tóxica (prerrenal): Forma un continuo con la fase de iniciación. Ocurre cuando disminuye el flujo sanguíneo renal, pero se mantiene la integridad celular.
2. Fase de iniciación: Aparece cuando el descenso del flujo sanguíneo renal provoca una depleción de ATP. Se produce la lesión de la célula tubular epitelial (pérdida de microvilli, exfoliación, etc.).
3. Fase de extensión: Se caracteriza por la persistencia de la hipoxia y la respuesta inflamatoria, ambos eventos más pronunciados en la unión corticomedular. Es en esta fase en la que la disfunción de la célula endotelial desempeña un papel fundamental: alteración de la permeabilidad, estado procoagulante, alteración en la regulación de las células proinflamatorias, liberación de citoquinas, etc. Se produce muerte celular: necrosis y apoptosis.
4.Fase de mantenimiento: En ella, las células comienzan a repararse: diferenciación, migración, apoptosis, proliferación en un intento de mantener la integridad celular y tubular.
5. Fase de recuperación: Se mantiene la diferenciación celular y se restablece la polaridad epitelial.
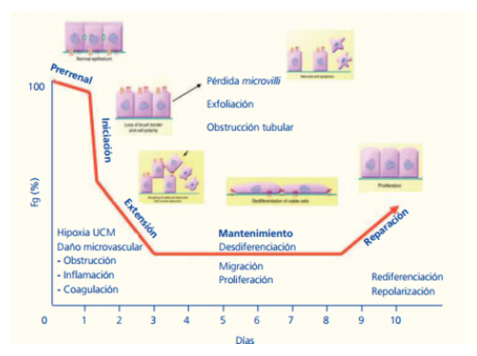
FIGURA 2: Las cinco fases evolutivas propuestas por Sutton et al. para la necrosis tubular aguda de origen isquémico. Sutton TA,et al .“Microvascular endothelial injury and dysfunction during ischemic acute renal failure”. Kidney Int 2002;62:1539-49.
Fármacos y NTA
Los fármacos antiinflamatorios no esteroideos (AINES) pueden inducir dos formas diferentes de lesión renal aguda: mediada hemodinámicamente y la nefritis intersticial aguda, que a menudo está acompañada por el síndrome nefrótico.
Los AINES inhiben a la enzima ciclooxigenasa (COX) inhibiendo la producción endógena de prostaglandinas y tromboxano.
Aunque las prostaglandinas renales son principalmente vasodilatadoras, no desempeñan un papel importante en la regulación de la hemodinámica renal en sujetos normales, ya que la tasa basal de síntesis de prostaglandinas es relativamente baja. Por el contrario, la secreción de estas últimas hormonas se incrementa en estados de depleción de volumen efectivo, como insuficiencia cardíaca, cirrosis y agotamiento de volumen verdadero debido a pérdidas gastrointestinales o salinas renales y agua.
En estos entornos, las prostaglandinas vasodilatadoras actúan para preservar el flujo sanguíneo renal y la tasa de filtración glomerular mediante la relajación de la resistencia preglomerular.
Nuestro paciente puede haber presentado una NTA de causa tóxica secundaria a AINES.
Nefropatías túbulo intersticiales (NTIA)
La nefritis intersticial aguda (NIA) se caracteriza por la presencia de infiltrados inflamatorios y edema en el intersticio, generalmente asociado a un deterioro agudo de la función renal.
Las principales causas de nefritis intersticialaguda pueden agruparse en:
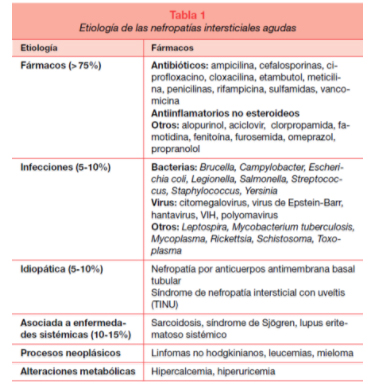
FIGURA 3: Etiología de las nefritis interaticiales agudas”Monte E; Nefropatías intersticiales ;Nefrología al día ,cap 4.
Patogenia: Por lo general se acepta que el evento inicial que desencadena un episodio de nefritis intersticial aguda es la expresión de antígenos endógenos nefritógenos, antígenos exógenos procesados por las células tubulares.
La patogenia de la nefritis intersticial aguda más común, la inducida por fármacos, también se cree que tiene una base inmunológica, como indica la aparición relativamente frecuente de manifestaciones extrarrenales de hipersensibilidad, su carácter independiente de la dosis y la recurrencia de la nefritis después de la reexposición al fármaco responsable.
Los fármacos y antígenos microbianos específicos podrían provocar una reacción inmunitaria después de su depósito intersticial (antígenos plantados). Por otra parte, las células tubulares tienen la capacidad de hidrolizar y procesar las proteínas exógenas. En este sentido, los medicamentos pueden unirse a un componente normal de la membrana basal tubular, actuando como hapteno, o pueden simular un antígeno que normalmente se encuentra dentro de la membrana, e inducir una respuesta inmunitaria contra este antígeno. Aunque la evidencia no es tan fuerte, algunos antígenos microbianos también podrían inducir una nefritis intersticial aguda a través de estos mecanismos.
El hecho de que sólo una minoría de los pacientes tratados con un medicamento en particular o que sufren un proceso infeccioso desarrollen una nefritis intersticial aguda indica que la expresión de antígenos nefritógenos en el túbulo y el intersticio renal es, probablemente, compensada por complejos mecanismos de protección, principalmente por las células T supresoras. Cuando se superan estos mecanismos de protección (probablemente sobre la base de una susceptibilidad determinada genéticamente) se produce la nefritis intersticial aguda, y tanto los estudios experimentales como la evidencia acumulada en los seres humanos indican que la inmunidad celular desempeña un papel patogénico importante. El propio antígeno, o una reacción cruzada con él, se presenta a los linfocitos T. Los linfocitos T activados inducen la diferenciación de los linfocitos T efectores, que actúan como mediadores de la hipersensibilidad retardada y la citotoxicidad.
Anatomía patológica: El edema intersticial es un hallazgo típico, mientras que los glomérulos y vasos son claramente normales. Los infiltrados intersticiales se componen principalmente de linfocitos (los linfocitos T CD4+ son el tipo más abundante), macrófagos, eosinófilos y células plasmáticas. Los granulomas intersticiales pueden observarse en algunos casos de nefritis intersticial aguda por fármacos, pero hay que tener en cuenta la posibilidad de que se trate de sarcoidosis, tuberculosis u otras infecciones cuando se encuentran. Los estudios de inmunofluorescencia son negativos en la mayoría de los pacientes. La microscopia electrónica muestra lesiones inespecíficas. En los pacientes con nefritis intersticial aguda inducida por AINES acompañada por síndrome nefrótico se observa borramiento difuso de los procesos de los podocitos. Los cambios fibróticos pueden verse 7-10 días después del inicio de un proceso inflamatorio, y progresan hacia la fibrosis intersticial avanzada acompañada de atrofia tubular.
Manifestaciones clínicas
En la tabla 2 se observan las características de la presentación clínica y de laboratorio publicadas recientemente en dos grandes series de pacientes con nefritis intersticial aguda, que incluyeron un total de 121 casos.

FIGURA 4: Clarkson M,et al “Interstitial neprihtis: clinical features and response to corticoidtherapy”(2004).Nefropatías intersticiales ;Nefrología al día ,cap 4.
Todos los pacientes presentaron un empeoramiento agudo de la función renal, cuya gravedad requirió diálisis en un porcentaje significativo de los casos. Los hallazgos clínicos específicos de la nefritis intersticial aguda por fármacos están relacionados con una reacción de tipo alérgico: fiebre de bajo grado, erupción cutánea maculopapular, artralgias y eosinofilia. Una característica es que esta eosinofilia es significativamente menos frecuente en las nefritis intersticiales agudas por AINES que en otros tipos de nefritis intersticial aguda inducida por fármacos.
La hematuria microscópica y la leucocituria son hallazgos muy frecuentes. Por otro lado, a pesar de que las series anteriores hacían hincapié en la búsqueda de eosinófilos en la orina, este dato no ha confirmado de manera concluyente su utilidad diagnóstica. Una gran mayoría de los pacientes presenta una moderada proteinuria, y el hallazgo de proteinuria en rango nefrótico o síndrome nefrótico completo con hipoalbuminemia parece ser poco frecuente, incluso en aquellos pacientes con nefritis intersticial aguda inducida por AINE.
A nivel ecográfico los hallazgos son inespecíficos, pudiendo encontrar aumento de ecogenicidad renal bilateral.
Como podemos ver nuestro paciente se presentó con varias de estas manifestaciones clínicas y analíticas.
Fármacos y NTIA
AINES
Los fármacos antiinflamatorios no esteroideos (AINES) también pueden causar nefritis intersticial aguda y síndrome nefrótico.
No se conoce bien el mecanismo causal pero se sugiere que por la inhibición de la COX hay una conversión preferencial del ácido araquidónico a la vía de los leucotrienos. Estos activarían a los linfocitos T helper desencadenado la NTIA.
El síndrome nefrótico generalmente se debe a una enfermedad de cambio mínimo, pero también se ha reportado nefropatía membranosa. Los pacientes que presentan nefritis intersticial aguda típicamente presentan hematuria, piuria, proteinuria y falla renal aguda. La recuperación espontánea generalmente ocurre dentro de unas semanas a unos pocos meses después de que se suspende el tratamiento.
Rifampicina
La rifampicina es bien conocida por su hepatotoxicidad no tanto así por su toxicidad renal .
El primer reporte de LRA por rifampicina data de 1971 (Poole,et al).
En el siguiente cuadro podemos observar la presentaciones clínicas de nefrotoxicidad por rifampicina:
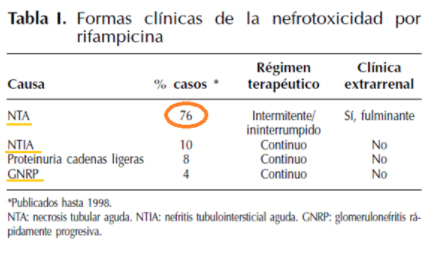
FIGURA 5: Fracaso renal agudo inducido por rifampicina A. Ortiz, A. Barat y H. Oliva. NEFROLOGÍA. Vol. XXI. Número 1. 2001
En general vemos que la forma más frecuente es la NTA, seguida por la NTIA, ambas asociadas principalmente a un régimen terapéutico intermitente como fue el caso de nuestro paciente.
En las dos series de casos más grandes de los últimos años de falla renal aguda inducida por rifampicina podemos obtener como conclusiones :
- Los síntomas más frecuentes fueron oligoanuria, síndrome pseudogripal y gastrointestinales.
- Trombocitopenia y anemia hemolítica autoinmune suelen estar asociadas empeorando la evolución.
- NTIA fue el hallazgo más frecuente en las biopsias renales.
- No hay variables al inicio predictoras de la severidad de la falla renal.
- Los factores pronósticos a corto plazo son : la severidad del proceso inmune y la duración de la fase anúrica.
- Evolución a largo plazo es favorable.
Por lo expuesto anteriormente es muy probable que nuestro paciente haya presentado una nefritis intersticial aguda por rifampicina.
INDICACIONES DE BIOPSIA RENAL EN NTIA
-
Análisis de orina característico para NTIA sin asociación a un fármaco conocido por causarla.
-
Pacientes que están siendo tratados con un fármaco conocido por causar NTIA pero no tienen un análisis de orina característico.
-
Pacientes que están siendo considerados para el tratamiento con glucocorticoides.
-
Pacientes (sin biopsia previa) que no mejoran después de los primeros cinco a siete días de tratamiento con esteroides.
-
Los pacientes con NTIA relacionado con fármacos que no son tratados con glucocorticoides inicialmente y no tienen una recuperación espontánea después de la suspensión de la terapia con fármacos.
-
Pacientes que presentan insuficiencia renal avanzada, cuyo inicio es reciente (tres meses).
-
Cualquier otra característica (como proteinuria de alto grado) que hagan que el diagnóstico de NTIA sea incierto.
TRATAMIENTO NTIA
El pilar principal es la suspensión del agente causal.
En cuanto al tratamiento con corticoides mucho se ha publicado sin llegar a un consenso siendo al día de hoy un tema sumamente controversial.
En el siguiente cuadro podemos ver un resumen y los resultados de las series de casos más importantes de los últimos años sobre nefritis intersticial y tratamiento corticoideo:
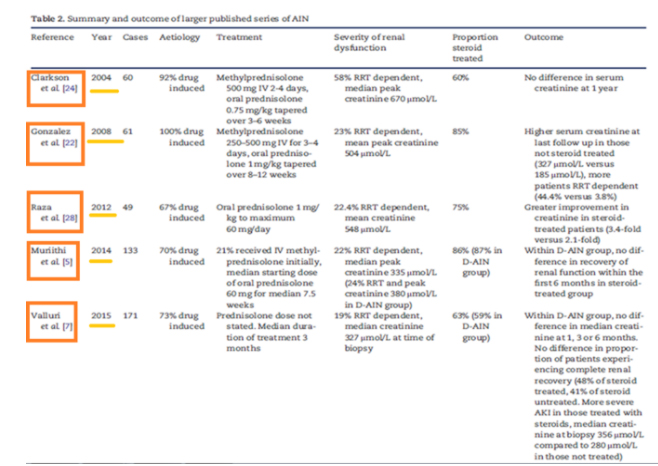
FIGUR A 6: Maria Prendecki,et al. “Long-term outcome in biopsy-proven acute interstitial nephritis treated with steroids”. Clinical Kidney Journal, 2016, 1–7.
Vemos que los resultados son discordantes en los estudios apoyando algunos el tratamiento corticoideo y otros no.
Entonces, ¿cuándo empezaríamos tratamiento?
- Ausencia de mejoría en función renal tras 1-2 semanas de retirada del fármaco .
- Empeoramiento progresivo de la falla renal en 2 -3 semanas .
- Idealmente en los primeros 7 días tras suspensión del fármaco.
- Posterior a resultado de biopsia renal .
- El tratamiento empírico es una alternativa razonable en pacientes con una historia fuertemente sugestiva de NTIA inducida por fármacos cuando no es factible la biopsia renal.
- Un dato a destacar es que en las NTIA secundaria a ANES los corticoides no parecen modificar el curso de la enfermedad.
¿Cómo lo realizaríamos?
Otros agentes terapéuticos : En casos de DEPENDENCIA ( recaídas durante la disminución de prednisona); INTOLERANCIA/CONTRAINDICACIONES y/o RESISTENCIA a los corticoides (ej: enfermedad inducida por AINE) .
Existen reportes de casos y series pequeñas usando micofenolato de mofetil (MMF) y ciclosporina, y uso anecdótico de ciclofosfamida.
Los estudios previamente mostrados tienen varias limitaciones ya que son pequeños, no randomizados y restropectivos. Esperamos el desarrollo de estudios multicéntricos, aleatorizados y prospectivos para un mejor abordaje del tema.
Glomerulopatías
No quería dejar de mencionar a las glomerulopatías en el diagnóstico diferencial de la FRA, teniendo en cuenta que nuestro paciente presentó hematíes dismórficos en un sedimento urinario.
El término glomerulonefritis (GN) o glomerulopatías se utiliza en forma amplia para designar las enfermedades que afectan la estructura y función glomerular, tratándose de entidades clínicas heterogéneas tanto en su etiología, manifestaciones, curso clínico y pronóstico, pero que tienen como denominador común el hallazgo histológico de inflamación del penacho glomerular (salvo cuatro excepciones puntuales que son la nefropatía diabética, nefroesclerosis hipertensiva, amiloidosis y nefropatías hereditarias) y que tienen implicado un mecanismo inmune en su fisiopatología.
Etiología:

FIGURA 7:Diagnosticapproach of glomerular disease in adults Leidy González, Acta Médica Colombiana Vol. 38 N°2.Abril-Junio 201
La expresión clínica de las GN es el resultado de la combinación de hematuria (macro o microscópica), proteinuria (con o sin síndrome nefrótico) y FRA en los casos en los que se produce bien aguda (síndrome nefrítico) o crónica. La hipertensión se asocia en un tercio de los casos. De acuerdo a los datos clínicos podemos clasificar las GN según 6 patrones :
-
Alteraciones urinarias asintomáticas: analíticamente se manifiesta como hematuria microscópica y/o proteinuria nunca > 3 g/día.
-
Hematuria macroscópica: brotes de hematuria macroscópica sin coágulos que típicamente pueden coincidir con infecciones intercurrentes. Entre los brotes el sujeto suele estar asintomático salvo que puede persistir hematuria microscópica y/o proteinuria leve-moderada.
-
Síndrome nefrótico: la presencia de proteinuria > 3.5 g/día en adultos y >40 mg/h/m2 en niños, con hipoalbuminemia.
-
Síndrome nefrítico: cuadro clínico agudo caracterizado por oliguria, hematuria, proteinuria generalmente < 3 g/día, edema e hipertensión arterial.
-
GN rápidamente progresiva: se caracteriza por la aparición gradual de proteinuria, hematuria y falla renal que progresa en un periodo de días o semanas.
-
GN crónica: se caracteriza por anomalías urinarias persistentes (hematuria microscópica), deterioro lento y progresivo de la función renal y proteinuria moderada o intensa. El tiempo de progresión hacia la insuficiencia renal terminal es variable.
Tratamiento :
Las terapias inmunosupresoras utilizadas actualmente en la glomerulonefritis no son uniformemente eficaces y se asocian frecuentemente con efectos secundarios graves. Además, dado que los pacientes con ciertas nefropatías (como la nefritis membranosa) pueden experimentar remisión espontánea, la decisión de iniciar la inmunosupresión no siempre es sencilla teniendo que considerar el diagnóstico, al paciente, la susceptibilidad a los efectos secundarios y factores pronósticos que puede ayudar a determinar el riesgo de progresión versus remisión para cada caso.
Los corticosteroides son eficaces en varios tipos de glomerulonefritis debido a su capacidad para inhibir la actividad del factor de transcripción nuclear B e inhibir los efectos proinflamatorios de la citoquinas conocidas por promover la inflamación glomerular (IL 1 y FNT).
La plasmaféresis para la eliminación de anticuerpos preformados de la circulación es útil en ciertos casos.
Otros agente como la ciclofosfamida, clorambucil y azatioprina son eficaces para suprimir la inflamación glomerular, pero no son específicos en sus acciones y causan morbilidad y mortalidad.
Las terapias inmunosupresoras tienen un beneficio en: glomerulonefritis rápidamente progresivas con semilunas, nefritis lúpica, glomeruloesclerosis focal y segmentaria, enfermedad de cambio mínimo, nefropatía membranosa y en casos de nefropatía por IgA con deterioro renal.
Tuberculosis (TBC) y enfermedad renal
Mundialmente, la tuberculosis es una enfermedad común, con 8 a 10 millones de nuevos casos anualmente. La forma más frecuente de presentación es la pulmonar seguida por la ganglionar y la genitourinaria.
Tuberculosis Renal Clásica
La tuberculosis del tracto urinario se pasa fácilmente por alto. Aunque se presente con los síntomas urinarios típicos recién se sospecha cuando no hay respuesta a los antibióticos habituales o cuando el examen de la orina revela piuria estéril. Los síntomas constitucionales como fiebre, pérdida de peso y sudores nocturnos son inusuales. Sólo un tercio de los pacientes presentan una radiografía de tórax anormal.
A nivel imagenológico se caracteriza por distorsión calicial , estenosis ureteral y calcificaciones.
Nefritis intersticial tuberculosa
Entidad poco frecuente, de presentación insidiosa que conlleva a insuficiencia renal crónica. Generalmente la enfermedad está avanzada al diagnóstico asociada por ende a un pobre pronóstico renal .
Se atribuye un mecanismo inmunológico como causal con evidencia a nivel histológico de granulomas típicamente sin bacilos ácido alcohol resistentes (BAAR) debiendo hacerse el diagnóstico diferencial con otras entidades como NTIA asociada a sarcoidosis o fármacos.
Glomerulonefritis
La tuberculosis crónica a veces es complicada por la amiloidosis.
Hay una serie de informes de casos de tuberculosis asociados con diversas formas de glomerulonefritis, pero no se han establecido asociaciones.
El tratamiento de la tuberculosis puede ser complicado en el contexto de NTIA. Si no se tolera la rifamicina, la duración del tratamiento debería ser de un mínimo de 12 meses en la TBC pulmonar, incluso para fármacos susceptibles, e inclusive más prolongado para forma diseminadas.
Aunque la rifabutina se puede intentar como una alternativa a la rifampicina, con el fin de intentar acortar la duración del tratamiento este medicamento a menudo resulta en una recurrencia de la NTIA.
En ausencia de un tratamiento adecuado para tuberculosis, la mortalidad puede ocurrir por una infección abrumadora.
En nuestro caso se realizó la interconsulta con el servicio de Infectología y como conducta se suspendió la rifampicina y se continuó tratamiento con isoniacida y etambutol con un régimen diario.
Diagnósticos diferenciales: dentro de las causas de falla renal intrínseca he expuesto la NTA, NTIA y las glomerulopatías faltando las causas vasculares por lo cual haré una breve mención.
Las principales entidades son la ateroembolia y la embolia renal. La primera se caracteriza por el hallazgos de trombos de colesterol difusos en pacientes añosos con factores de riesgo como arterioesclerosis y enfermedad cardíaca. La segunda es una entidad rara, caracterizada por la oclusión bilateral de las arterias renales por émbolos manifestandose con un cuadro súbito de lumbalgia y falla renal aguda oligúrica, siendo la angio tomografía de abdomen /arteriografía definitorias para el diagnóstico.
No considero que sean causas posibles de la falla renal de nuestro paciente.
Tratamiento de la falla renal aguda
Tratamiento de soporte: evitar balances negativos /positivos (oligúricos); evitar nefrotóxicos; ajustar dosis fármacos; adecuado aporte nutricional (20-30 kcal/kg/día) y proteico (1,5 mg/kg/día) y control metabólico.
Terapia de reemplazo renal : es necesaria en el 85% de las FRA oligúrica y en el 30-40% FRA no oligúrica.
Indicaciones de inicio de hemodiálisis :
-
Urea plasmática > 1 g/L, con síndrome urémico.
-
Hipercalemia > 6 mEq/L , refractaria al tratamiento médico.
-
Acidosis metabólica con pH < 7,15 refractaria al tratamiento médico.
-
Sobrecarga de líquidos (edema agudo de pulmón ,shock cardiogénico), refractaria al tratamiento médico.
-
Alteraciones electrolíticas graves ( Na/ Ca/P).
Evolución y consideraciones finales
Realizando un breve resumen para finalizar, nuestro paciente es derivado por una FRA oligúrica que no responde al tratamiento médico por lo que a las 24 horas de su ingreso es vinculado a hemodiálisis.
A las 48 hrs de su ingreso por no poder descartar una NTIA de causa farmacológica se decide en conjunto con Infectología suspender la rifampicina, continuando el tratamiento de fase de consolidación para su tuberculosis pulmonar con isoniacida y etambutol. La administración de AINES estaba contraindicada desde el ingreso.
Tras la suspensión del fármaco el paciente evoluciona con falla renal progresiva sin recuperación del ritmo diurético con requerimiento de hemodiálisis inicialmente diario.
7 días luego de su ingreso, se realiza la biopsia renal con un informe preliminar de nefritis tubulointersticial aguda farmacológica (pendiente inmunofluorescencia).
Actualmente presenta leve mejoría de su función renal que se mantiene estable en los últimos días con un adecuado ritmo diurético, asintomático.
Como diagnóstico final sostengo que nuestro paciente presenta una nefritis tubulointersticial aguda secundaria a fármacos, probablemente por la rifampicina.
Antes de obtener el resultado de la biopsia, que es el goldstandart para el diagnóstico, proponía como diagnósticos diferenciales una necrosis tubular aguda tóxica farmacológica y más alejado una nefritis tuberculosa, quedando estos ya descartados.
De todas formas por la presencia de hematíes dismórficos en el último sedimento urinario no podemos descartar alguna glomerulopatía asociada ,que se puede haberse manifestado en este paciente como un síndrome nefrítico.
Por dicho motivo me planteo la posibilidad de realizar una nueva biopsia renal, ya que la actual fue poco representativa (se observaron con cortes finos 4 glomérulos). Además, se conoce que la afectación glomerular puede ser parcheada (focal).
Lo segundo que me planteo es si nuestro paciente es pasible de recibir tratamiento corticoideo. Creo que se podría tomar una conducta expectante. Hace 15 días que se suspendió la rifampicina y evoluciona con mejoría de la función renal. Por otro lado, hay que tener en cuenta su tuberculosis pulmonar que si bien está controlada podría no verse favorecida con los esteroides. Mientras tanto, debemos continuar con el tratamiento de soporte y dialítico si lo requiere.
Es importante destacar lo fundamental del abordaje multidisciplinar (Nefrología e Infectología) en estos casos para un correcto abordaje de la patología y seguimiento del paciente.
Bibliografía
- M.Clarkson ,et al . “Acute interstitial nephritis : clinical features and response to corticosteroyd therapy”.Nephrol Dial Transplant Vol 19 N 11.
- Poole G, Stradling P, Worlledge S: “Potentially serious side effects of high-dose twice-weekly rifampicin”. BMJ 3:343-347, 1971.
- Adrian Covic ,et al. “Rifampicin-induced acute renal failure: a series of 60 patients” 1998. European Renal Association–European Dialysis and Transplant Association.
- ThangamaniMuthukumar,et al. “Acute Renal Failure Due to Rifampicin: A Study of 25 Patients”. American Journal of Kidney Diseases, Vol 40, No 4 (October), 2002: pp 690-696.
- Valluri ,et al . “Acute tubulointerstitial nephritis in Scotland” Q J Med 2015; 108:527–532.
- E González,ét al. “Early steroid treatment improves the recovery of renal function in patients with drug-induced acute interstitial nephritis”. Kidney International (2008) 73, 940–946.
- Dean C. Preddie,* Glen S. Markowitz, “MycophenolateMofetil for the Treatment of Interstitial Nephritis”. Clin J Am SocNephrol 1: 718–722, 2006.
- Ming‑Hua Shang, Nan Zhu, et al. “Membranous Nephropathy Associated with Tuberculosis”. Chinese Medical Journal.March 5, 2016. Volume 129.Issue 5.
- K.V. Kanodia1, et al. “Crescentic Glomerulonephritis Associated with Pulmonary Tuberculosis”. Journal of Clinical and Diagnostic Research. 2016 Jan, Vol-10(1): ED01-ED02.
- Quratulain Kizilbash. “Successful management of acute interstitial nephritis in two cases of disseminated tuberculosis”. Tuberculosis 101 (2016) S135eS136.
- M.T. Tenorio, C. Galeano, et al . “Diagnóstico diferencial de la insuficiencia renal aguda”.NefroPlus 2010;3(2):16-32.
- P. Monederoa, N. García-Fernández; “Insuficiencia renal aguda” RevEspAnestesiolReanim. 2011;58:365-374.
- Monte E; “Nefropatías intersticiales”.Nefrología al día ,cap 4.
- Nuria Montero, et al . “Correlación entre el cociente proteína/creatinina enorina esporádica y las proteínas en orina de 24 horas”.Nefrologia 2012;32(4):494-501.
- Ortiz, A. Barat ,et al. “Fracaso renal agudo inducido por rifampicina” NEFROLOGÍA. Vol. XXI. Número 1. 2001
- Alfredo Jover-Sáenz,et al.Servicio de Medicina Interna.Hospital Universitario Arnau de VilanovaLeida. España.EnfermInfeccMicrobiolClin 2006;24(1):64-7.
- “Estudio de caso realizado en el Servicio de Nefrología de Hospital Central Militar de Bogotá D.C., Colombia”. Revista Salud Bosque .Volumen 1.Número 1.Págs. 47-53.
- Leidy González. “Diagnosticapproach of glomerular disease in adults, Acta Médica Colombiana Vol. 38 N°2 .Abril-Junio 2013.
- José Manuel Porcel-Pérez, et al. “Nefritis intersticial aguda por rifampicina”.EnfermInfeccMicrobiolClin 2006;24(1):64-7.
- S J Chadban, R C Atkins. “Glomerulonephritis”. Lancet 2005; 365: 1797–806
- Julio César García .”Membranous glomerulonephritis associated with the use of non-steroidal anti-inflama tory drugs. Case report”. RevistaSalud Bosque. Volumen 1.Número 1.Págs. 47-53.
- Chapter 9:“ Infection-related glomerulonephritis”.Kidney International Supplements (2012) 2, 200–208; Kidney International Supplements (2012) 2, 200–208.
- P. Monederoa, N. García-Fernández. “Insuficiencia renal aguda”. RevEspAnestesiolReanim. 2011;58:365-374.
- F de los Ríos. “Insuficiencia renal aguda”.
- Ortiz, A. Barat y H. Oliva “Fracaso renal agudo inducido por rifampicina”. NEFROLOGÍA. Vol. XXI. Número 1. 2001.
- Dres. Rinaldo Bellomo, John A Kellum,et al. Lesión renal aguda. AcutekidneyinjuryLancet 2012; 380: 756–66.
- W. Mallison, R. W. Fuller. “Diffuse Interstitial Renal Tuberculosis—an Unusual Cause of Renal Failure”
- Ester González Monte. “Nefropatías intersticiales”. Nefrología al día. Cap 4.
- Maria Prendecki,et al . “Long-term outcome in biopsy-proven acute interstitial nephritis treated with steroids” Clinical Kidney Journal, 2016, 1–7.
- Jerome Rossert. “Drug-induced acute interstitial nephritis”. Kidney International, Vol. 60 (2001), pp. 804–817.
- Amanda Chapagain. “Presentation, diagnosis, and treatment outcome of tuberculous-mediated tubulointerstitial nephritis”. Kidney International (2011) 79, 671–677.
- John B. Eastwood ,et al. “Tuberculosis and tubulointerstitial nephritis: an intriguing puzzle”. Kidney International (2011) 79, 579 – 581.
- Jonh Eastwood,et al . “Tuberculosis and the Kidney” J Am SocNephrol 12: 1307–1314, 2001.
- Clinical manifestations and diagnosis of acute interstitial nephritis
- Manuel Praga, et al . “Clinical manifestations and diagnosis of acute interstitial nephritis” Up to Date .2012.
- Abhijit V Kshirsagar, et al. “Treatment of acute interstitial nephritis”. Up to Date .2012.
- Burton D Rose,et al . “NSAIDs: Acute kidney injury (acute renal failure) andnephrotic syndrome”. Up to Date .2012.
- Burton D Rose,et al . “Renal disease in tuberculosis”.Up to Date .2012.
- Abhijit V Kshirsagar, et al .“The significance of urinary eosinophils.Up to Date .2012.
|