Discusión del caso clínico. | Presentación |
Objetivos de la discusión:
- revisar las causas de neuropatía periférica.
- describir las características del síndrome de Guillain-Barré.
- analizar las variantes de este síndrome y su abordaje en la práctica clínica.
- realizar consideraciones finales.
Las neuropatías periféricas son un grupo diverso de trastornos que afectan a los nervios periféricos. Las mismas se pueden clasificar según diversas características en:
- Mono neuropatías o poli neuropatías, de acuerdo a si afectan uno o más nervios.
- Agudas o crónicas, según tengan un tiempo de evolución menor o mayor a 4 semanas.
- Simétricas o asimétricas.
- Proximales o distales.
- Motoras, sensitivas, sensitivo-motoras, autonómicas; de acuerdo al tipo de nervio que afecten.
- Desmielinizante, axonal o mixta, según el tipo de lesión nerviosa.
Los antecedentes personales del paciente son de vital importancia para comprender la etiología de la neuropatía periférica; de esta forma, la misma puede ser secundaria a enfermedades auto inmunitarias, como síndrome de Sjögren, lupus o artritis reumatoide; cáncer por infiltración de fibras nerviosas o síndromes paraneoplásicos; diabetes mellitus; infecciones virales y bacterianas; virus de la inmunodeficiencia humana (VIH); toxinas ambientales o industriales, como el plomo, el mercurio y el arsénico; consumo excesivo de alcohol; déficit nutricionales (como de vitamina B12, tiamina y ácido fólico).
Nuestro paciente no presenta ninguna comorbilidad, no ha tenido consumo agudo de drogas previo al inicio del cuadro, no ha estado en contacto con tóxicos ambientales ni industriales y no presenta alteraciones metabólicas. Por otra parte, no considero que su cuadro se deba a déficit nutricional ya que hubiese presentado un cuadro más gradual, de instauración en semanas o meses.
Por lo tanto, teniendo en cuenta las características de las neuropatías periféricas, nuestro paciente presenta una POLINEURORRADICULOPATÍA AGUDA, SIMÉTRICA, PROGRESIVA, SENSITIVO-MOTORA, INFLAMATORIA, lo cual constituye la definición de SÍNDROME DE GUILLAIN-BARRÉ.
El Síndrome de Guillain-Barré (SGB) es una polirradiculoneuropatía desmielinizante inflamatoria aguda monofásica, con lesión axonal en los casos más avanzados. Su fase de inicio es siempre menor a cuatro semanas, y luego progresa por una a tres semanas hasta alcanzar una meseta.
Es una condición heterogénea con varias formas clínicas diferentes, considerada como la causa más frecuente de parálisis flácida.
Se caracteriza por debilidad progresiva, arreflexia, síntomas sensoriales leves, disfunción autonómica (sudoración profusa, hipertensión, taquicardia, incontinencia urinaria), afección de pares craneales (diplejía facial) y de músculos respiratorios, pudiendo presentar insuficiencia respiratoria hasta en el 25% de los casos.
La incidencia mundial reportada es de 0,6 a 4 por cada 100.000 habitantes por año, aunque se observa un aumento del 20% por cada 10 años de vida después de la primera década de vida. Suele afectar a personas de cualquier edad y sexo con 2 picos de presentación: uno en la etapa adulta joven (15-34 años) y otra entre los 60-74 años. La relación hombre-mujer es de 1,78.
Desde su descubrimiento y descripción en el año 1916 se han propuesto diferentes criterios para su diagnóstico. Los utilizados por el Instituto Nacional de Enfermedades Neurológicas y Stroke (NINDS) son los siguientes:
Características requeridas para el diagnóstico:
- Debilidad progresiva simétrica de los miembros, pudiendo llegar a plejía de los 4 miembros, el tronco, los músculos faciales y parálisis bulbar.
- Hipo o arreflexia.
Otras características acompañantes:
- Progresión de los síntomas en días y hasta 4 semanas.
- Alteración sensitiva.
- Compromiso de pares craneales, específicamente parálisis facial bilateral (diplejía facial).
- Comienzo de la recuperación entre 2 y 4 semanas luego del inicio de los síntomas.
- Disfunción autonómica.
- Elevación de proteínas en el LCR.
- Alteraciones electrofisiológicas.
Características que alejan el diagnóstico:
- Debilidad persistente o asimétrica.
- Nivel sensitivo.
- Recuento celular en LCR mayor a 50 mm3.
- Disfunción vesical o intestinal persistente.
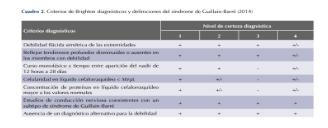
En el año 2014 un grupo holandés del University Medical Centre Rotterdam, en un estudio con una cohorte que incluyó a 567 pacientes, estableció los criterios diagnósticos de Brighton, los cuales no solo describen las principales características del síndrome sino que también lo clasifican en cuatro niveles de certeza diagnóstica en función de las características del paciente y la disponibilidad de información del mismo. Son los criterios más utilizados en la actualidad.
Respecto a la etiología del SGB, en el mismo se produce una lesión nerviosa postinfecciosa, inducida por la inmunidad. Más de dos tercios de los casos son precedidos por síntomas de infección de las vías respiratorias superiores o diarrea, y otras causas asociadas como desencadenantes del cuadro; pueden ser vacunas, cirugías y traumatismos.
El agente infeccioso asociado más frecuentemente con la aparición del SGB es el Campylobacter jejuni en un 20-50% de los casos, seguido por: Citomegalovirus (5-22%), Haemophylus influenzae (2-13%), Epstein-Barr (10%) y Mycoplasma pneumoniae en aproximadamente un 5% de los casos. En menor proporción se ha reportado: borreliosis de Lyme, hepatitis de tipos A, B, C y E, fiebre tifoidea, dengue, influenza A, chikungunya y VIH. El virus Zika es la infección precedente identificada más recientemente, con aumento de su incidencia en varios países en 2016.
En cuanto a la patogénesis de esta enfermedad, la misma incluye una reacción inmunológica aberrante que termina por dañar los nervios. Para comprender dicha respuesta es importante destacar que existen moléculas denominadas gangliósidos, las cuales forman parte de las membranas celulares, tanto en sistema nervioso central como periférico, de células formadoras de mielina. Durante las infecciones prodrómicas del SGB, se desencadena una cascada inmunológica con producción de anticuerpos contra los lipopolisacáridos del agente causal (por ejemplo, membrana del Campylobacter jejuni). Existe un mimetismo molecular entre epítopos (región antigénica reconocida por los anticuerpos) bacterianos y neurales. Como consecuencia de esto, la respuesta inmune (anticuerpos antigangliósido) se dirige contra los lipopolisacáridos de los patógenos responsables de la infección, pero también contra los gangliosidos de las células de nervios periféricos. Los anticuerpos se unen a los antígenos de la mielina y activan al complemento, lo cual estimula la generación del complejo de ataque de membrana (MAC) en la superficie de las células de Schwann, llevando a una degeneración vacuolar de la mielina. Seguido a esto, los macrófagos invaden la mielina y actúan removiendo los restos de la misma. Toda esta reacción inmunológica genera edema endoneural; con incremento de la presión neural y consecuentemente reducción crítica del flujo sanguíneo transperineural con isquemia del nervio.
Existen mas de 180 tipos de gangliosidos, y estos se distribuyen de manera diferente en los distintos nervios, lo cual podría ser la causa de las diferentes manifestaciones clínicas en el SGB y sus variantes, ya que los anticuerpos se producen frente a determinados gangliosidos. GQ1b se expresan predominantemente en el nervio motor ocular externo (VI par), petetico (IV par) y oculomotor (III par), así como en los husos musculares de los músculos inervados. Así la presencia de anti-GQ1b conduce a la afectación de pares craneales oculomotores. El GM2 se expresa en el nervio facial y los antígenos GM1, GM1b, GD1a, y GalNAc-GD1a son propios del axolema de nervios motores periféricos a nivel de los nódulos de Ranvier.
El nexo patogénico entre anticuerpos antigangliósido y SGB no está, sin embargo, completamente establecido, dado que la presencia de los anticuerpos es inconstante, y sólo una mínima parte de pacientes con infecciones específicas (p.ej., C. jejuni) experimentan SGB. Esto sugiere que para el desarrollo del SGB es preciso que la infección precipitante encuentre un terreno inmunológico predispuesto, como el de los sujetos con determinados haplotipos del sistema HLA o polimorfismos del receptor de los linfocitos T.
Entre los estudios complementarios que se utilizan en el diagnóstico del SGB la punción lumbar se realiza, no sólo para confirmar el diagnóstico, sino también para descartar enfermedades infecciosas o malignas. La característica del LCR es la DISOCIACIÓN ALBUMINOCITOLÓGICA con concentraciones altas de proteínas y recuento de leucocitos normal.
Esta disociación albuminocitológica es frecuente durante la segunda semana; está presente en no más del 50% de los pacientes durante la primera semana de la enfermedad, aunque esta proporción aumenta al 75% en la tercera semana.
Ante un LCR normal, repetir la punción lumbar puede ser confuso, ya que el recuento de células y proteínas puede estar influenciado por la primera punción lumbar y por el tratamiento. Se recomienda repetir la PL solo en casos de duda diagnóstica.
En el estudio publicado en la revista BRAIN en el año 2014, se realizó una punción lumbar en 474 pacientes durante dos semanas, encontrándose un aumento en la proporción de disociación albuminocitológica en los LCR luego de la segunda semana de síntomas (49% en los primeros días vs 88% luego de los 14 días).
En nuestro paciente, se realizó una punción lumbar a su ingreso y luego otra a la semana de inicio de los síntomas, después de 5 días de tratamiento, encontrándose un leve aumento de las proteínas (0,58 g/l en la 2da PL), lo cual resulta compatible con un SGB.
Los estudios electrofisiológicos son mucho más útiles para el diagnóstico del SGB, contribuyen a confirmar la presencia y la gravedad de la neuropatía y permiten revelar si los síntomas son causados por degeneración de la capa de mielina, responsable de la alta velocidad de conducción, o del axón. Las velocidades lentas de transmisión o el bloqueo del impulso tienden a indicar daño en la capa de mielina, mientras que una reducción en la fuerza de los impulsos a velocidades normales es un signo de degeneración axonal.
Sin embargo, se debe tener en cuenta que durante los primeros días del SGB, la velocidad de conducción puede ser normal o ligeramente descendida. Probablemente la mejor explicación a esto sea que la isquemia endoneural que produce bloqueo a la conducción nerviosa no es uniforme, inicia en forma parcheada durante los primeros días, manteniéndose la velocidad de conducción. Este dato resulta importante en el caso de nuestro paciente en el cual, el primer estudio de neuro conducción, resultó normal. A pesar de ello, se decidió realizar un nuevo estudio electrofisiológico luego de casi dos semanas de iniciado el cuadro, el cual resultó compatible con polineuropatía distal y simétrica de los 4 miembros con lesión axonomielinopática leve.
Cabe destacar que el nuevo estudio se solicitó teniendo en cuenta que los hallazgos patológicos en el SGB tienen valor pronóstico; el hallazgo de degeneración axonal tiene peor pronóstico debido a una recuperación más lenta o severa incapacidad residual, y por el contrario, la desmielinización presenta mejor pronóstico a largo plazo.
Variantes del síndrome
- SGB paraparético: debilidad en piernas, hipo-arreflexia, los nervios torácicos no están afectados. La función vesical está conservada y no hay un nivel sensitivo definido.
- Debilidad faríngo-cérvico-braquial: debilidad orofaríngea, cuello y brazo simétrica o unilateral; hipo-arreflexia brazo. Ausencia de debilidad en piernas.
- Parálisis facial bilateral y parestesias: ausencia de oftalmoplejía, ataxia y debilidad en los miembros. Parestesias de las extremidades. Es una forma localizada desmielinizante.
- Variantes motora pura, sensitiva pura, atáxica pura.
- Pandisautonomía: síntomas disautonómicos (diarrea, vómitos, mareos, hipotensión ortostática, retención urinaria, sudoración, salivación y lagrimeo) con hipo-arreflexia y síntomas sensitivos.
- Polirradiculopatía lumbar bilateral.
- Encefalitis de Bickerstaff: encefalitis del tronco cerebral, alteración de la conciencia, hiperreflexia, oftalmoplejía y ataxia. Ausencia de debilidad en las extremidades.
- Síndrome Miller Fisher: oftalmoplejía, ataxia y arreflexia/hiporreflexia.
El síndrome de Miller Fisher es la variante más común del SGB. Representa el 5% de los casos. Se caracteriza por la triada de oftalmoplejía, ataxia y arreflexia. También presenta diplopía en forma frecuente, como presentó nuestro paciente. Otros síntomas menos comunes consisten en disestesias, blefaroptosis, pupilas hiporreactivas y parálisis facial, todos síntomas que también presentó el paciente a su ingreso.
Aunque la debilidad de los miembros no forma parte característica de este cuadro, puede estar presente en el 20-25% de los pacientes, y la disminución de la sensibilidad superficial puede ser detectada en el 20-50% de los casos, lo cual constituye un nexo claro con el SGB. Ambas alteraciones estuvieron presentes en nuestro paciente.
El pico de los síntomas se produce en una semana y la recuperación clínica comienza en forma paulatina a las dos semanas, con mejoría de la ataxia y oftalmoplejía en 1 a 3 meses; la arreflexia puede persistir más tiempo, pero sin generar discapacidad funcional. La recuperación completa se produce generalmente a los 6 meses.
En el síndrome de Miller Fisher, los anticuerpos contra GQ1b están presentes en el 85 a 90% de los pacientes, siendo estos superiores a la disociación albuminocitológica para el diagnóstico.
Enfermedades que imitan al SGB
Existen algunas enfermedades que pueden presentar síntomas o formas de presentación similares al SGB, las cuales se describen en el siguiente cuadro, con las principales características que las diferencian.
Mielitis transversa |
Nivel sensitivo, incontinencia urinaria. Sin afección facial ni bulbar. LCR pleocitosis mayor a 200 |
Miastenia Gravis |
Reflejos normales. Debilidad maseterina. Fatigabilidad. Sin disautonomía. EMG: VC normal y APA disminuida. LCR normal. |
Neuropatía vasculítica |
Historia de vasculitis. Mononeuritis múltiple. Comienzo gradual. Marcada asimetría. |
Meningitis carcinomatosa |
Cambios conductuales y del sensorio. Afección asimétrica de los nervios craneales. |
Botulismo |
Antecedente de ingestión de alimentos o herida. Síntomas G-I. Ptosis palpebral, Sequedad de boca, ojos, y piel. Parálisis proximal, midriasis no reactiva, bradicardia. LCR normal. |
Polineuropatías metabólicas (DBT, IR, déficit vitamínicos, alcohol) |
Desarrollo lento, disestesias, dolor urente, alteración propioceptiva y trastornos tróficos. LCR normal. |
Esclerosis lateral amiotrófica |
Comienzo aleatorio y asimétrico. Hiperreflexia, espasticidad, movimientos oculares conservados. |
Enfermedad de Lyme |
Eritema migratorio, meningoencefalitis con afección de pares craneales. Artritis, miocarditis. LCR pleocitosis. |
Porfiria aguda intermitente: defecto en la enzima porfobilinógeno deaminasa (síntesis del grupo hemo). Hereditaria. |
Dolor abdominal. Debilidad proximal ascendente, convulsiones, coma. Crisis de hipertensión arterial, taquicardia y trastornos neuropsiquiátricos. Hiponatremia/SIADH. Porfirinas en orina. |
La Porfiria Aguda Intermitente (PAI) es una de las enfermedades que puede presentar síntomas similares al SGB, con la cual se debe realizar diagnóstico diferencial. La PAI se caracteriza por el déficit parcial de la enzima porfobilinógeno deaminasa, la tercera enzima en la biosíntesis del grupo hemo. Las crisis agudas aparecen generalmente cuando factores precipitantes como el ayuno, el consumo de alcohol o tabaco, las infecciones o los fármacos aumentan su demanda o estimulan su síntesis por la vía del citocromo p450. Esto desencadena una producción excesiva de precursores como la alanina (ALA) y PBG, responsables a su vez de la toxicidad neurovisceral y del cuadro clínico.
Se transmite de forma autosómica dominante. Se caracteriza por la aparición de episodios agudos de dolor abdominal, crisis de hipertensión arterial, taquicardia y trastornos neuropsiquiátricos, llegando incluso a provocar convulsiones, parálisis ascendente o coma. No obstante, la enfermedad cursa también con grandes periodos asintomáticos. Entre otras manifestaciones, destacan las alteraciones electrolíticas severas, como hiponatremia secundaria a SIADH. El diagnóstico se realiza por un alto índice de sospecha clínica y la demostración de una excreción urinaria elevada de los metabolitos precursores (porfirinas), común durante los ataques.
En el artículo titulado “Diagnóstico tardío de un caso de porfiria aguda intermitente en una unidad de cuidados intensivos” realizado en el año 2010 por el servicio de Medicina Intensiva del Hospital de la Santa Creu i Sant Pau, Barcelona, España, se describe el caso de un paciente que estuvo internado 7 meses en UTI por un cuadro de debilidad proximal de las extremidades inferiores que progresó hasta afectar las extremidades superiores con crisis comiciales, sin déficit sensitivo ni de pares craneales, con disociación albumino-citológica e hiponatremia. Tres años luego del alta del paciente, el mismo reingresó por debilidad muscular de predominio distal e hiponatremia, con afección de músculos respiratorios. En esta ocasión se realizó estudio de porfirinas en sangre, orina y heces que resultó ser positivo, realizándose el diagnóstico de PAI.
El diagnóstico del SGB se basa fundamentalmente en la clínica, asociado a los hallazgos del LCR y los estudios electrofisiológicos.
Otros estudios que pueden realizarse para el diagnóstico son:
-
Estudios serológicos en búsqueda de la respuesta frente a los probables agentes causales (Campylobacter jejuni, CMV, Epstein-Barr, Mycoplasma pneumoniae).
-
Análisis de drogas y toxinas, como probables desencadenantes del cuadro.
-
HIV, FAN, Factor Reumatoideo, complemento.
-
Anticuerpos para gangliósidos GMI, GDIa Y GQIb.
Respecto a los anticuerpos antigangliósios, los mismos están presentes en el 90% de los casos de síndrome de Miller-Fisher, disminuyen hasta desaparecer en 4-5 semanas y permite confirmar el diagnóstico en síndromes incompletos o síntomas atípicos. Sin embargo, estos anticuerpos tienen más interés académico que práctico, teniendo en cuenta que en nuestro medio los mismos presentan un alto costo y demoran varios días en obtenerse los resultados.
Tratamiento
Dentro de las medidas terapéuticas generales, deben realizarse, al ingreso de un paciente con sospecha de SGB, una prueba de disfunción deglutoria y una espirometría con determinación de la capacidad vital, debido a la posibilidad de compromiso de la deglución y de los músculos respiratorios. Ambas pruebas fueron realizadas a nuestro paciente, encontrándose alteración de la deglución y disminución de la capacidad vital con patrón restrictivo severo, el cual mejoró notablemente luego del tratamiento instaurado.
El tratamiento específico del SGB es la inmunoterapia, la cual se puede realizar con inmunoglobulina intravenosa (IGIV) o plasmaféresis.
El mecanismo de acción de la plasmaféresis implica la eliminación de anticuerpos y otros posibles componentes inflamatorios, como el complemento, y puede mejorar la función supresora de las células T. En general el tratamiento inicial comprende 5 series. Su eficacia aumenta cuando se comienza dentro de los 7 días del inicio de los síntomas.
La IGIV, por su parte, presenta un mecanismo de acción múltiple, que implica la neutralización de anticuerpos, disminución de la proliferación de linfocitos T y la síntesis de citoquinas proinflamatorias incluyendo la IL-1, FNT-a e interferón gama. Así mismo, induce la apoptosis de linfocitos y monocitos, contiene anticuerpos que se unen a la porción Fab para neutralizar auto anticuerpos e interfiere con la activación del sistema de complemento.
La dosis de inmunoglobulina intravenosa es de 0,4 g/kg por día durante 5 días.
Luego de la inmunoterapia, se sugiere observar el paciente durante una semana. En caso de no mostrar ninguna mejora o presentar mayor deterioro, se sugiere reiterar la misma modalidad de tratamiento (recambio plasmático o inmunoglobulina intravenosa) en estrecha observación para evitar efectos secundarios. Se recomienda no cambiar de IGIV a plasmaféresis porque eliminará la IG circulante y sus potenciales efectos beneficiosos.
Los efectos adversos de la inmunoterapia incluyen:
En el caso de la plasmaféresis, pueden presentarse infecciones relacionadas al catéter, trombosis venosa profunda, alteraciones hemodinámicas, reacciones alérgicas y hemolisis. Con el tratamiento con inmunoglobulina intravenosa puede haber fiebre, malestar general, nauseas, mialgias e inestabilidad hemodinámica. Respecto a la elección de tratamiento, existe extensa bibliografía que compara las ventajas y desventajas de ambos métodos. A modo de resumen de las mismas, se realizó en el año 2014 una revisión Cochrane de 12 estudios que comparaban ambos tratamientos, llegándose a las siguientes conclusiones:
La IGIV acelera la recuperación en el SGB en la misma medida que el intercambio plasmático.
Los eventos adversos no fueron significativamente más frecuentes con ninguno de los tratamientos, aunque es significativamente más probable que el tratamiento con inmunoglobulina intravenosa se complete, en comparación con el intercambio plasmático.
La administración de inmunoglobulina intravenosa después del intercambio plasmático no confirió un beneficio adicional significativo.
En otro estudio, realizado en Colombia en el año 2016, denominado “Minimización de costos: inmunoglobulina IV vs. plasmaféresis en síndrome de Guillain-Barré” se realizó una comparación entre pacientes tratados con ambos métodos, llegándose a la conclusión de que el tratamiento hospitalario con IGIV tiene significativamente menor costo que el tratamiento con plasmaféresis, debido a que los paciente tratados con IGIV requieren menor tiempo de estancia hospitalaria, pocos ingresos destinados al cuidado crítico y presentan menos complicaciones.
La recuperación suele comenzar después de la segunda o tercera semana. Debe tenerse en cuenta que el tiempo se acorta un 40 - 50% con el tratamiento con específico. En el caso de nuestro paciente, se pudo observar una notable mejoría en los signos y síntomas a partir de los primeros días del tratamiento con inmunoglobulina.
La mayoría de los pacientes recuperan la capacidad de deambular, incluso en casos graves, pero la discapacidad sigue siendo hasta de un 10%. Para una adecuada recuperación es importante la neuro rehabilitación intensiva luego de la etapa aguda del SGB.
La discapacidad se puede evaluar a través de la escala de Hughes. A su ingreso, nuestro paciente se encontraba en un nivel 5, confinado a la cama. Luego de 2 semanas de internación, se pudo otorgar el alta hospitalaria del paciente, encontrándose entonces en un nivel 3-2 de discapacidad, pudiendo deambular por sus propios medios.

La mortalidad estimada del SGB es del 3%, pero es el doble en pacientes que recibieron respiración asistida durante meses y puede llegar al 10% - 20% en pacientes con enfermedades preexistentes, en especial EPOC y vejez.
Un síntoma importante, que se debe tener presente en el SGB, es el dolor. Es un síntoma frecuente y puede presentarse en el 70-80% de los casos, en cualquier estadío de la enfermedad, generalmente de intensidad moderada a severa.Es de tipo neuropático y característicamente peor por la noche, lo cual se pudo observar en el caso de nuestro paciente.
Para su tratamiento se recomienda el uso de drogas como gabapentin y carbamacepina, las cuales se unen a los canales de calcio o sodio voltaje dependientes, generando disminución en la transmisión del dolor. Otras drogas que se pueden utilizar para el tratamiento del dolor son los antidepresivos tricíclicos, los inhibidores de la recaptación de serotonina y noradrenalina y los opiáceos.
Finalmente, quisiera hacer una breve referencia al tratamiento de Mycoplasma pneumoniae, ya que resultó ser el probable agente causal del SGB en nuestro paciente. En el artículo sobre neumonías atípicas publicado en la revista Clinics in Chest Medicine de EE.UU en el 2016, se describen las drogas, dosis y días de tratamiento recomendadas para infecciones por M. pneumoniae. En nuestro medio las drogas más utilizadas son Claritromicina y Levofloxacina, y el tiempo recomendado de tratamiento es de 10 a 14 días. En dicho artículo se destaca que las manifestaciones extrapulmonares del M. pneumoiae son debidas a la respuesta inflamatoria generada, y no directamente a la bacteria, por lo que el tratamiento debe ser con las mismas drogas y la misma duración, asociado a la inmunoterapia correspondiente.
Para concluir, nos encontramos frente al caso de un hombre joven, sin antecedentes de jerarquía, que se presenta con un SGB, en su variante Miller Fisher, probablemente secundario a neumonía por Mycoplasma pneumoniae, el cual presentó una rápida recuperación luego de la inmunoterapia con 5 dosis de inmunoglobulina, pudiendo otorgarse el alta hospitalaria luego de 2 semanas de internación. En dicho contexto, propongo realizar un adecuado seguimiento del paciente, teniendo en cuenta que si presenta nuevos episodios de debilidad en miembros en un futuro, deberán evaluarse otros posibles diagnósticos como la porfiria aguda intermitente, la neuropatía secundaria a tóxicos y la polirradiculopatía desmielinizante inflamatoria crónica.
Se debe realizar también un adecuado plan de tratamiento del dolor neuropático y hacer hincapié en la neuro rehabilitación para disminuir las secuelas del síndrome.
Por último, algunos aprendizajes que nos deja este caso clínico son los siguientes:
- Las alteraciones en el LCR y en la neuro conducción se tornan evidentes luego de la 1er semana.
- No se requiere necesariamente de la investigación de los anticuerpos anti gangliósidos para confirmar el diagnóstico.
- La rapidez en el tratamiento mejora notablemente la evolución y la recuperación de los pacientes.
- Existe una elevada frecuencia de dolor neuropático.
Bibliografía:
-
Christiaan Fokke, Bianca van den Berg, Judith Drenthen, Christa Walgaard, Pieter Antoon van Doorn, Bart Casper Jacobs. “Diagnosis of Guillain-Barré syndrome and validation of Brighton criteria”. Brain, Volume 137, Issue 1, 1 January 2014, Pages 33–43.
-
Nobuhiro Yuki, Hans-Peter Hartung. “Guillain–Barré Syndrome”. New England Journal of Medicine. June 2012.
-
Neuropatía periférica. National Institute of Neurological Disorders and Stroke.
-
Eelco F.M. Wijdicks, Christopher J. Klein. “Guillain-Barré Syndrome”. Mayo Clinic Proceedings. March 2017
-
Sindrome de Guillain-Barré. INTRAMED. 2012
-
K. Gastón, S. Lasdica, L. Bustamante, D. Fainstein, P. Casas, D. Maurizi. “Sindrome de Miller Fisher. Presentación de un caso y revisión de la literatura”. Revista Sociedad Argentina de Medicina Intensiva. 2006
-
Benjamin R Wakerley, Nobuhiro Yuki. “Mimics and chameleons in Guillain–Barré and Miller Fisher síndromes”. Pract Neurol 2015
-
Juan Jesús Rodríguez Urangaa, Francisco Delgado Lópeza, Emilio Franco Macíasa, María Bernal Sánchez Arjonaa, Carlos Martínez Quesadaa, Alfredo Palomino García. “Síndrome de Miller-Fisher: hallazgos clínicos, infecciones asociadas y evolución en 8 pacientes”. Medicina Clínica. 2004
-
Ricardo Rojas-García, Eduard Gallardo, Carmen Serrano-Munuera, Noemí de Luna, Esther Ortiz, Carles Roig, Josep M. Grau-Veciana, Isabel Illa. “Anticuerpos anti-GQ1b: utilidad de su determinación en el diagnóstico del síndrome de Miller-Fisher”. Medicina Clínica. Volume 116, Issue 20, 2001, Pages 761-764
-
A.J. Betbeséa, L. Zapata, C. Martínez-Brúb, C. Herreroc. “Diagnóstico tardío de un caso de porfiria aguda intermitente en una unidad de cuidados intensivos”. Med Intensiva 2010.
-
Lokesh Sharma, Ashley Losier, Thomas Tolbert, Charles S. Dela Cruz, Chad R. Marion. “Atypical Pneumonia Updates on Legionella, Chlamydophila, and Mycoplasma Pneumonia”
-
Meyer Sauteur PM, Huizinga R, Tio-Gillen AP, Roodbol J, Hoogenboezem T, Jacobs E, van Rijn M, van der Eijk AA, Vink C, de Wit MC, van Rossum AM, Jacobs BC. “Mycoplasma pneumoniae triggering the Guillain-Barré syndrome: A case-control study”. Ann Neurol. 2016.
-
Fabio Enrique Suárez, Gloria Isabel Ortiz, Juan Pablo Mogollón, Liliana Clavijo, Paola Andrea Ortíz, Jesús Hernán Rodríguez, Jorge Mutis. “Minimización de costos: inmunoglobulina IV vs. plasmaféresis en síndrome de Guillain Barré”. Acta Neurológica Colombiana.
-
Richard AC Hughes, Anthony V Swan, Pieter A van Doorn. “Intravenous immunoglobulin for Guillain‐Barré síndrome”. Cochrane Database of Systematic Reviews. September 2014
|
Imágenes del caso
|