Historia
Existen
referencias de que en el antiguo Egipto se sabía que el
LCR envolvía al cerebro. En el siglo XVI se realizó la
primera descripción de su presencia en las cavidades
ventriculares. En 1692 Antonio Valsalva y un siglo
después Domenico Cotugno describieron la continuidad del
sistema ventricular y subaracnoideo. En 1827 Francois
Magendie hizo la primera descripción completa del LCR
incluyendo su producción y reabsorción. En 1891 el
médico alemán Heinrich Quincke realizó la primera
punción lumbar y estudió la presión del LCR y sus
variaciones junto a Hans Queckenstedt.
En
1912
Mestrezat, Sicard y Guillain describieron la composición
química del LCR, y Widal, Sicard y Ravaut su citología.
En 1918 el Neurocirujano Walter Dandy realizó la primera
ventriculografía y en 1920 realizó la primera punción
cisternal.
Introducción
El
líquido cefalorraquídeo (LCR) es un líquido incoloro,
que baña el encéfalo y la médula espinal. Circula por el
espacio subaracnoideo, los ventrículos cerebrales y el
canal medular central. Es producido en los plexos
coroideos de los ventrículos cerebrales y en el epitelio
ependimario. En conjunto, el líquido cefaloraquídeo, el
sistema ventrículo-cisternal, el epitelio ependimario y
el coroideo, constituyen un órgano complejo que lleva a
cabo funciones de protección mecánica, neuroendócrina y
de autoregulación del medio interno encefálico y
sistémico.
Producción y absorción del líquido cefalorraquídeo
La
producción del LCR tiene dos orígenes: el plexual y el
extraplexual. El origen plexual se refiere a los plexos
coroideos de los 4 ventrículos cerebrales (Primero y
Segundo -laterales-, Tercero, y Cuarto), y tienen a
cargo la producción de aproximadamente el 70% del LCR.
Los plexos coroideos son estructuras formadas por un
gran número de capilares que forman una red y están
rodeados por células similares a las epiteliales pero
que, en conjunto, no están soportadas por una lámina
basal. Tienen una base afilada con prolongaciones que se
unen a los oligodendrocitos para poder utilizar el
plasma sanguíneo y ultrafiltrarlo. Esta red está situada
en las paredes de los ventrículos cerebrales,
fundamentalmente en los ventrículos Primero y Segundo.
El proceso de producción se lleva a cabo en tres
instancias: 1) ultrafiltrado a través de los capilares
de los plexos corideos y absorción de dicho
ultrafiltrado por las células del epitelio coroideo, 2)
transformación dentro de la célula del epitelio
coroideo, y 3) excreción dentro del sistema ventricular.
El
origen extraplexual se refiere a la producción de LCR
que se lleva a cabo en el epitelio ependimario a partir
del líquido intersticial. Ésta representa el 30% de la
producción. La producción total de LCR tiene un caudal
de 0.35 ml/minuto ó 500 ml/día. En un adulto sano el
volumen total de LCR es de 150 ml y se renueva
completamente cada 3 ó 4 horas.
Factores
que reducen la producción de LCR son algunos fármacos,
como los esteroides y diuréticos, la baja temperatura
corporal, la baja presión de perfusión cerebral y la
presión intracraneana (PIC) elevada.
La
reabsorción del LCR es directamente proporcional a su
presión. Comienza con 5 mmHg y se eleva linealmente
hasta los 20 mmHg. Cuando la presión de LCR supera a la
de los senos venosos, la reabsorción se interrumpe.
Circulación del líquido cefaloraquídeo
El LCR
formado en los ventrículos laterales pasa al Tercer
ventrículo a través de los agujeros de Monro. Desde
éste, por el acueducto de Silvio, ingresa al Cuarto
ventrículo. Desde allí atraviesa los orificios de
Luschka y el de Magendie, y accede a las cisternas y al
saco dural espinal. Por el óbex accede al conducto
ependimario medular.
El flujo
del LCR alterna la dirección caudal con la cefálica. La
corriente principal se realiza en sentido caudal y el
reflujo cefálico es producido por turbulencia. En el
canal espinal existe un flujo bidireccional continuo:
caudal en la superficie dorsal y cefálico en la
superficie ventral.
El flujo
de LCR se encuentra influenciado por el movimiento
ciliar ependimario, los movimientos respiratorios, el
pulso arterial y el gradiente de presión entre el
sistema ventricular-subaracnoideo y el venoso.
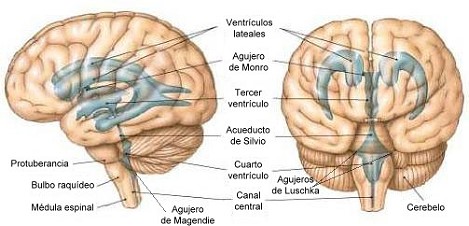
Figura 1:
esquema anatómico del sistema ventricular cerebral
Física del líquido cefaloraquídeo
Si
tenemos en cuenta el principio de Pascal, decimos que la
presión del LCR es la fuerza que el mismo ejerce sobre
el tejido cerebral por unidad de superficie. Éste es el
valor fisiopatológico de verdadera importancia y no la
presión del LCR en sí. La presión del LCR varía de
acuerdo al sitio anatómico donde se coloque el sistema
de medición y, a su vez, a la posición del sujeto al
momento del registro. En la cisterna magna la presión se
encuentra normalmente entre 0 y 12 cm H2O,
mientras que en los ventrículos laterales se encuentra
entre -5 y 8 cm H2O. A nivel lumbar la
presión es de 6 a 18 cm H2O en decúbito
lateral y de 18 a 25 cm H2O con el paciente
sentado. En niños pequeños las presiones son menores y
en recién nacidos pueden ser incluso subatmosféricas.
La
barrera hematoencefálica (BHE)
El medio
interno cerebral es más estable comparado al del resto
del organismo, lo cual se consigue gracias a la BHE.
La BHE
más que una capa pasiva de células, es un complejo
metabólico activo con múltiples bombas, transportadores
y receptores para neurotransmisores y citoquinas.
El papel
del endotelio capilar del sistema nervioso central en
patologías neurológicas mediadas inmunológicamente se ha
reconocido hace algunos años, y este conocimiento se ha
utilizado para desarrollar estrategias de tratamiento en
enfermedades como la esclerosis múltiple.
Ahora,
específicamente en el cerebro, existen algunas áreas
funcionalmente especiales (: la hipófisis, la eminencia
media, el área postrema, el receso preóptico, la pineal
y el plexo coroide), que no poseen BHE (es decir, que en
ellas el endotelio capilar es similar al de otros lechos
microvasculares sistémicos).

Figura 2:
esquema de la Barrera hematoencefálica
Química del líquido cefaloraquídeo
En la
química del LCR se describen cloruros, glucosa,
proteínas y enzimas.
1.
Cloruros:
Los valores normales se hallan entre los 700-750 mg/dl
(116-127 mEq/l). Su concentración se encuentra en
relación directa con la plasmática, aunque en las
meningitis tuberculosa y bacteriana hay
hipoclorurorraquia (<500 mg/dl).
2.
Glucosa:
Su cifra normal es de 40 a 70 mg/dl en el adulto, y de
60 a 80 mg/dl en el niño. Siempre hay que compararla con
el nivel de glucemia, ya que la glucorraquia normal es
del 60 al 70% de la glucemia medida simultáneamente y en
ayunas. La hiperglucorraquia carece de significado
patológico; en cambio, la hipoglucorraquia (< 40 mg/dl)
indica consumo excesivo de glucosa por elementos
celulares (inflamatorios -como los que se ven en la
meningitis bacteriana, tuberculosa y fúngica- o
neoplásicos).
El valor
de la glucorraquia es especialmente útil en el
diagnóstico diferencial de las meningitis a líquido
claro (tuberculosa y algunas fúngicas –en las que la hay
hipoglucorraquia-, y viral -en las que la glucorraquia
es normal-).
3.
Proteínas:
Su concentración es menor que en el suero. Los valores
normales están comprendidos entre 20 y 45 mg/dl. El
proteinograma normal en el LCR es muy similar al
plasmático:
·
Prealbúmina (2,3-6,9%)
·
Albúmina (52,8-73%)
·
Alfa-1 (3,7-8,1%)
·
Alfa-2 (4,2-8,8%)
·
Beta (7,3-14,5%)
·
Gamma (3,0-9,0%)
La
elevación de la albúmina y de las globulinas suele ser
paralela a la elevación del número de células, pero
algunas veces no ocurre así, y son altas las proteínas y
normal el número de células (disociación
albuminocitológica). Aunque el aumento de proteínas en
el LCR es un dato poco específico, ya que aparece en
numerosos procesos inflamatorios (infecciosos y no
infecciosos), y neoplásicos, la disociación
albuminocitológica es propia de situaciones de bloqueo
del flujo del LCR a lo largo del conducto espinal
(tumores, etc.), y de procesos inflamatorios
inmunomediados (síndrome de Guillain-Barré).
En
procesos inflamatorios meníngeos sin bloqueo de LCR
suele predominar el aumento de células sobre el de
proteínas.
En la
actualidad es posible medir fracciones proteicas
específicas en el LCR, que tiene valor diagnóstico en
diversas enfermedades (Ejs.: proteína básica de la
mielina en la esclerosis múltiple; antígenos microbianos
en procesos infecciosos; alfa-2-microglobulina en el
complejo demencia-SIDA).
Las
gammaglobulinas difunden pasivamente desde la sangre y
normalmente no son producidas en el espacio intratecal;
pero, en algunas enfermedades (ciertas meningitis
crónicas, infecciones por virus lentos y
desmielinizantes como la Esclerosis Múltiple), en las
que hay un aumento específico de IgG, ésta se produce
localmente.
4.
Enzimas:
-
Creatincinasa (CK). El valor medio es inferior a 4
U/l. Se eleva en lesiones cerebrales isquémicas.
-
Adenosín-deaminasa (ADA). Los valores normales están
alrededor de 0,4 U/l. Aumenta de forma
característica en la meningitis tuberculosa, pero
también en infiltración por linfomas.
-
Lactato-deshidrogenasa (LDH). Sus niveles normales
son un 10% de la concentración sérica. Aumenta en
traumatismos cerebrales, afecciones degenerativas,
convulsiones, meningoencefalitis y tumores.
-
Lisozima: Su aumento es habitual en las meningitis
bacterianas agudas.
5.
Ácido láctico:
Su concentración puede variar de forma independiente a
los valores plasmáticos. Se piensa que esto tiene que
ver con la existencia de un metabolismo anaeróbico en el
SNC. El ácido láctico aumenta en cualquier alteración
asociada con disminución del flujo sanguíneo cerebral
(Ej. En una lesión cerebral traumática). También
contribuye al diagnóstico diferencial entre las
meningitis bacterianas y virales (se encuentra aumentado
en el 90% de las meningitis bacterianas y en el 10% de
las meningitis virales). Su valor normal está entre
1.5-1.9 mmol/L.
Células del líquido cefaloraquídeo
En
adultos, el número debe ser inferior a 5/mm3 (μl),
correspondiendo a linfocitos un 60-70 %, a monocitos un
30-50 % y a neutrófilos un 1-3 %. El significado de un
recuento entre 5 y 10 células es dudoso, pero por encima
de 10 células es inequívocamente patológico. En niños,
las cifras de leucocitos aumentan hasta 20-30/mm3, sobre
todo en los menores de un año.
La
pleocitosis de 100-500/mm3, o más células, se manifiesta
en las meningitis supuradas (predominio polimorfonuclear),
linfocitarias y tuberculosa grave (predominio
linfocitario), y en la ruptura de abscesos cerebrales.
La pleocitosis ligera (10-30/mm3) y moderada
(30-100/mm3) con predominio linfocitario se presenta
también en procesos crónicos: abscesos cerebrales y, a
veces, en la esclerosis múltiple y la neurosífilis.
Asimismo, existe una pleocitosis en la encefalitis por
herpes
zoster y
en tumores cerebrales y medulares. Las meningitis
asépticas, como la recurrente de Mollaret, la secundaria
a sarcoidosis o la del lupus eritematoso sistémico
suelen cursar con pleocitosis linfocitaria. La
pleocitosis eosinófila se debe a parasitosis como la
cisticercosis cerebral, y a gliomatosis meníngea. En
ciertos tumores pueden encontrarse células tumorales.
Funciones del líquido cefaloraquídeo
-
Proteger mecánicamente el Sistema Nervioso Central,
como amortiguador de las fuerzas de aceleración y
desaceleración.
-
Mantener el medio interno encefálico estable
respecto al sistémico. Los cambios de pH del LCR
(cuyos valores normales son: 7,31 a 7,43) modifican
las funciones neurovegetativas y desencadenan
mecanismos (como la variación de la frecuencia
respiratoria) de control sistémico del estado
ácido-base.
-
Representa a la linfa de las meninges y el tejido
nervioso, ya que éstos no poseen vasos o canales
linfáticos.
-
Constituye el vehículo para sustancias
neuromoduladoras involucradas en la regulación de
funciones vitales: quimiorreceptores, hormonas de la
neurohipófisis, del hipotálamo y de la glándula
pineal.
-
Teniendo en cuenta que el tejido ependimario,
piamadre y aracnoides son avasculares, el LCR
también juega un rol nutricional.
Bibliografía:
1.
Srifuengfung
S, Chokephaibulkit K. Detection of bacterial antigen in
cerebrospinal fluid in patients with bacterial
meningitis: a literature review. J
2.
Med Assoc
Thai. 2010 Nov;93 Suppl 5:S71-5.
3.
Poulikakos PJ,
Sergi EE, Margaritis AS, Kioumourtzis AG, Kanellopoulos
GD, Mallios PK, Dimitrakis DJ, Poulikakos DJ, Aspiotis
AA, Deliousis AD, Flevaris CP, Zacharof AK. A case of
recurrent benign lymphocytic (Mollaret's) meningitis and
review of the literature. J Infect Public Health. 2010
Dec;3(4):192-5. Epub 2010 Nov 9.
4.
Muroi C, Mink
S, Seule M, Bellut D, Fandino J, Keller E. Monitoring of
the inflammatory response after aneurysmal subarachnoid
haemorrhage in the clinical setting: review of
literature and report of preliminary clinical
experience. Acta Neurochir Suppl. 2011;110(Pt 1):191-6.
5.
de Almeida SM, Faria FL, de Goes Fontes K, Buczenko GM,
Berto DB, Raboni SM, Vidal LR, Nogueira MB.
Quantitation
of cerebrospinal fluid lactic acid in infectious and
non-infectious neurological diseases. Clin Chem Lab Med.
2009;47(6):755-61.
6.
Michalke B,
Nischwitz V. Review on metal speciation analysis in
cerebrospinal fluid-current methods and results: a
review. Anal Chim Acta. 2010 Dec
7.
3;682(1-2):23-36. Epub 2010 Oct 8.
8.
Xu HB, Jiang
RH, Li L, Sha W, Xiao HP. Diagnostic value of adenosine
deaminase in cerebrospinal fluid for tuberculous
meningitis: a meta-analysis. Int J Tuberc Lung Dis.
2010 Nov;14(11):1382-7.
9.
Johanson C,
Stopa E, Baird A, Sharma H. Traumatic brain injury and
recovery mechanisms: peptide modulation of
periventricular neurogenic regions by the choroid
plexus-CSF nexus. J Neural Transm. 2011
Jan;118(1):115-33. Epub 2010 Oct 10.
10.
Nau R, Sörgel
F, Eiffert H. Penetration of drugs through the
blood-cerebrospinal fluid/blood-brain barrier for
treatment of central nervous system infections. Clin
Microbiol Rev. 2010 Oct;23(4):858-83.
11.
Oshorov AV,
Lubnin AIu. [Intracranial pressure. Intracranial
pressure monitoring]. Anesteziol Reanimatol. 2010
Jul-Aug;(4):4-10.
12.
Connor SE.
Imaging of skull-base cephalocoeles and cerebrospinal
fluid leaks. Clin Radiol. 2010 Oct;65(10):832-41.
13.
Strik H,
Prömmel P. Diagnosis and individualized therapy of
neoplastic meningitis. Expert Rev Anticancer Ther. 2010
Jul;10(7):1137-48.
14.
Ghanem KG.
REVIEW: Neurosyphilis: A historical perspective and
review. CNS Neurosci Ther. 2010 Oct;16(5):e157-68. doi:
10.1111/j.1755-5949.2010.00183.x. Epub 2010 Jul 8.
15.
Rose CF.
Increase brain lactate in hepatic encephalopathy: cause
or consequence? Neurochem Int. 2010 Nov;57(4):389-94.
Epub 2010 Jul 2.
16.
Adams RD,
Victor M, Romper AH.
Principios de Neurología
Sexta edición en castellano.
Mc Graw- Hill-
Interamerican, 1999:11-16
17.
Crockard AH,
R; Of., J.T. Devenlopmentof the Bood- Braian Barrier and
Ppropierts of CSF in the Developing Brain. En
Neurosurgery. The Scientific Basic of Clinical Practice
.N.r. Saunders 2nd.
Edition Blackwell Scientific Publications. 1992: 22-37
18.
De Myer
W. Técnica del Examen Neurológico. Texto Programado.
Tercera Edición. Editorial Médica Panamericana S.A.
1982: 497-513
19.
Fustinoni O; Fustinoni O(h). Semiología del Sistema
Nervioso. Decimoprimera Edición. Librería “El Ateneo”
Editorial. 1987: 305-318
20.
Gotta
H; Morete de Pardal ML. Breviario Semiologico del
Sistema Nervioso. Segunda Edición EUDEBA Ediciones
Previas 1976:109-115
21.
Lindsay
KW.; Bone I; Callander R. Neurología y Neurocirugía
Ilustrada. Versión Española Angeles Peiro. 1993: 467-496
22.
Osembach RK;
Zeidman SM. Infections in Neurogical Surgery. Diagnosis
and Management. Lipicott- Raven Publishers.
1999